2025年10月Science期刊精华
来源:生物谷原创 2025-10-30 09:40
2025年10月份即将结束,10月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.冬天更不适合吃零食?Science:氢化脂肪会干扰生物钟,让身体错把寒冬当盛夏囤能量
DOI: 10.1126/science.adp3065
下次冬季想拆开一包含氢化脂肪的加工零食时,或许得先想想:这口脂肪可能正在给身体的 “季节时钟” 发错误信号——让它误以为现在是食物丰饶的夏天,进而催生对高热量食物的持续渴望。过去科学家认为,哺乳动物全靠日照长短感知季节,比如黑熊靠日照变长知道春夏该囤积脂肪、日照变短就准备冬眠。
但加州大学旧金山分校团队发表在《科学》杂志的新研究发现,饮食中多不饱和脂肪酸(PUFA)与单不饱和脂肪酸(MUFA)的比例,和日照一样关键,甚至能通过调控一种叫 PER2 的生物钟蛋白,直接决定身体是否能正确适应季节变化。

PER2 蛋白是人体昼夜节律的 “核心齿轮”,之前研究已发现它能协调睡眠 - 觉醒周期和脂肪代谢,而这次研究找到了它的 “季节调节开关”——第 662 位丝氨酸(PER2-S662)的磷酸化状态。当小鼠吃高脂饮食(HFD,尤其是 PUFA:MUFA 比例低的)时,下丘脑中 PER2-S662 的磷酸化水平会升高,这会让它们适应冬季的速度变慢:在模拟冬季的 “4 小时光照、20 小时黑暗” 环境中,吃普通饲料的小鼠每天能提前 0.25 小时开始活动,而吃 HFD 的小鼠仅能提前 0.12 小时,30 天后累计差出 2 小时 “时差”;相反,HFD 却让小鼠适应夏季(20 小时光照、4 小时黑暗)更快,2 天就比普通饲料组多延迟 1 小时活动。
更关键的是 “脂肪类型的影响”。研究团队专门制作了两种等热量高脂饲料:一种用玉米油(高 PUFA,PUFA:MUFA 高),另一种用部分氢化玉米油(PHCO,PUFA 被转化为 MUFA,PUFA:MUFA 低)。结果发现,吃 PHCO 的野生型小鼠,下丘脑 PER2-S662 磷酸化水平更高,适应冬季更慢(每天仅提前 0.15 小时,比玉米油组慢 40%),适应夏季更快;但如果是 PER2-S662G 突变小鼠(这个位点无法磷酸化),不管吃玉米油还是 PHCO,季节适应速度都没差别,这直接证明,脂肪是通过调控 PER2-S662 磷酸化来影响生物钟的。
2.Science:利用转录组学的主动学习框架识别疾病表型的调节因子
DOI: 10.1126/science.adi8577
生物技术公司Cellarity宣布,其一篇阐述如何整合先进转录组数据集与AI模型以改进药物发现框架的论文已在《科学》杂志正式发表。该公司致力于通过整合多组学与AI建模开发细胞状态校正疗法。
Cellarity通过聚焦于定义和调控细胞状态的通路连接与相互作用网络,针对复杂疾病设计新型疗法。公司构建了一个强大的发现平台,利用高维转录组学以单细胞分辨率绘制这些相互作用图谱。

为该平台开发的通用AI模型将化学与疾病生物学联系起来,从而高效生产能够恢复病变组织细胞功能的药物。从该平台诞生的首个候选药物CLY-124,目前正处于治疗镰状细胞病的I期临床试验评估阶段。
Cellarity首席数据官Parul Doshi表示:"我们相信,对细胞状态的全面审视将帮助我们创造能够纠正疾病根本机制的更好疗法。我们先进的平台使我们能够有效可视化这一动态过程,并识别最适合纠正疾病状态的新型干预措施。这篇发表在《科学》杂志上的论文描述了为我们平台提供依据的评估工作,强调了成功整合先进转录组学和计算工具所需的严谨性与独创性,以实现新型候选疗法的高效发现。"
该论文提出了一个可重复且通用的蓝图,用于将机器学习方法整合到药物研发项目中,以最大化发现潜力。该蓝图通过采用由高通量转录组学驱动的、主动的"实验室在环"深度学习框架,解决了传统表型药物筛选的诸多局限性。通过根据实验结果持续优化预测,该框架证明其表型活性化合物的回收率比行业标准方法提高了13至17倍。
3.线虫端粒酶 RNA 玩“隐身”!20 年遗传谜题破解:藏进生殖基因内含子“搭车”传后代,抗衰老有新靶点
DOI: 10.1126/science.ads7778
端粒是染色体末端的 “保护帽”,就像鞋带末端的塑料头,每次细胞分裂都会缩短一点——体细胞端粒变短会引发皱纹、细胞衰老,而生殖细胞靠端粒酶 “修复” 端粒,才能让后代拥有完整的染色体。人类和哺乳动物的端粒酶里,有个关键的 RNA 模板(由 TERC 基因编码),可在线虫身上,科学家找了 20 年都没发现独立的 TERC 基因,却偏偏能检测到端粒酶活性。

这个 “矛盾” 成了遗传学界的未解之谜,直到日本理化学研究所(RIKEN)生物系统动力学研究中心 Hiroki Shibuya 团队在《科学》杂志发表新研究,才揭开真相:线虫的端粒酶 RNA 根本没 “独立门户”,而是躲在另一个基因的 “废弃片段” 里,靠 “搭便车” 精准定位到生殖细胞,确保物种代代相传。
为了找到这个 “隐身的 RNA”,研究团队先给秀丽隐杆线虫(C. elegans)做了基因改造——让端粒酶的催化亚基(FLAG-TRT-1)过量表达,这样就能通过增强交联免疫沉淀(eCLIP)技术,捕捉到和它结合的 RNA。
结果在一堆数据里,他们发现所有信号都集中在一个叫 nmy-2 的基因的第 2 个内含子里——这个基因本身编码非肌肉肌球蛋白 II,在生殖细胞中高度活跃。团队把这个隐藏的 RNA 命名为 terc-1,它不仅有和线虫端粒 DNA(5′-(TTAGGC) n-3′)互补的模板序列(5′-UAAGCCUAAG-3′),还能和 TRT-1 紧密结合,完美扮演端粒酶 RNA 的角色。
4.改写遗传学规则!Science:基因的起点和终点并非孤立运作,起点决定终点
DOI: 10.1126/science.ado8279
分子生物学家长期认为,基因的起点仅仅是转录过程的“启动开关”——DNA被复制为RNA,进而指导蛋白质合成。然而,波士顿大学与马萨诸塞大学陈医学院联合在《Science》上发表的最新研究,彻底颠覆了这一传统认知。研究发现,基因的起点和终点并非孤立运作,而是像一对默契的舞伴,在基因组中协同移动。这一机制重塑了细胞构建蛋白质的方式,也揭示了生物在进化中灵活适应的新路径。
“我们的工作改写了教科书,”该研究的共同通讯作者、波士顿大学生物学助理教授 Ana Fiszbein 强调,“基因的起点不仅决定转录从哪里开始,它还直接影响了转录在哪里结束,甚至决定了最终合成的蛋白质种类。”她进一步解释道:“我们过去教导学生,起点只负责‘鸣枪起跑’。而现在我们证实,它同样参与设定‘终点线’——基因的起点在暗中控制着它的终点。”

为了揭开这一规律,团队分析了来自 GTEx 项目的 17350 个人体组织样本(覆盖 54 种组织)和 ENCODE 项目的长读长 RNA 测序数据,发现超过 70% 的哺乳动物基因存在多个 TSS 和 PAS,但这些 “备选起点” 和 “备选终点” 并非随机搭配:比如 MYO10 基因在 H9 细胞中,从上游 TSS 启动的 mRNA,94% 会在 upstream PAS 终止;而从下游 TSS 启动的 mRNA,59% 会选择下游 PAS。这种 “序数匹配” 在不同组织中都稳定存在,哪怕某些基因在不同组织只表达一种 isoform(mRNA 变体),跨组织分析仍能发现 PITA 协同的痕迹。
为了证明这种关联是 “因果” 而非 “巧合”,团队用 dCas9-CRISPR 技术做了精准实验:激活 ZNF638 基因的上游 TSS 后,该基因的上游 PAS 使用量显著增加,下游 PAS 则减少;反之,激活下游 TSS 时,下游 PAS 的使用率也跟着上升。更关键的是,若删除下游 PAS,TSS 的选择虽会变化,却不会触发 PITA 协同。这说明 PITA 是 “单向调控”:起点决定终点,而非反之。
5.Science:我国科学家揭示人类跳跃基因LINE-1靶向结构化DNA来重塑基因组
DOI: 10.1126/science.adu3433
长散布核元件-1(Long interspersed nuclear element-1, LINE-1, L1)是人类基因组中唯一活跃的、能够自我复制的遗传元件,约占基因组的17%。它通常被称为"跳跃基因"或"逆转录转座子",因为它能够从一个基因组位置"逆转录转座"(移动)到另一个位置。
中国科学院生物物理研究所的研究人员现已揭示了L1逆转录转座并整合进基因组DNA的分子机制。他们的研究于10月9日发表在《科学》杂志上。
转座过程由逆转录酶ORF2p通过一种称为"靶向引发逆转录"的机制介导。在此之前,ORF2p如何识别DNA靶标并介导整合的机制一直不清楚。

在徐瑞明教授、朱冰教授和薛愿超教授的领导下,研究人员纯化了一个具有活性的ORF2p-内源核酸复合物,并利用单颗粒冷冻电子显微镜解析了其高分辨率三维结构。结构分析显示,ORF2p通过强烈的表面静电相互作用与基因组DNA结合。分析还表明,cDNA(互补DNA)的合成发生在逆转录酶活性中心,这是通过对多个氨基酸残基进行变构调节实现的。
重要的是,研究人员建立了首个高效的ORF2p体外DNA切割系统,证明其作为一种结构依赖性的内切核酸酶发挥作用。他们发现ORF2p对特定的叉状DNA底物(尤其是DNA复制过程中滞后链特征的瓣状结构)表现出高催化活性。
6.Science:裸鼹鼠体内cGAS介导的机制增强DNA修复并延缓衰老
DOI: 10.1126/science.adp5056
裸鼹鼠是自然界最非凡的生物之一。这些穴居啮齿类动物的寿命可达37年,大约是体型相近的近亲物种的十倍。但它们极端长寿的秘诀是什么?它们是如何延缓其他啮齿动物所经历的衰老和机能衰退的?根据发表在《科学》杂志上的一项新研究,答案至少部分在于一种常见蛋白质的功能转换,这种转换增强了DNA修复能力。
包括人类在内的所有动物,其衰老的主要原因之一是受损DNA的积累。当这种损伤得不到修复时,就会导致细胞缺陷、蛋白质受损,并最终导致身体功能崩溃。

为了解裸鼹鼠为何如此抵抗DNA损伤,一项由中国同济大学研究人员领导的研究聚焦于一种名为cGAS的常见蛋白质。在大多数哺乳动物中,cGAS会干扰DNA修复,但研究人员怀疑它在长寿的裸鼹鼠体内可能进化出了不同的功能。
研究团队将裸鼹鼠的cGAS蛋白与人类和小鼠的进行了比较,发现了四个氨基酸的改变,这些改变翻转了该蛋白质的功能,使其能够增强细胞修复受损DNA的能力。
7.Science:新研究揭示MTAP缺乏赋予癌细胞对细胞质核酸感应和STING激动剂的抵抗性
DOI: 10.1126/science.adl4089
细胞质核酸感知通路已成为增强免疫检查点阻断疗效的有前景的治疗靶点,尤其是在免疫学上的"冷"肿瘤中。这些通路的激活会刺激I型干扰素(IFN-I)信号传导和干扰素刺激基因(ISG)的表达,促进免疫细胞募集,并可能将冷肿瘤转化为免疫活跃的"热"肿瘤。干扰素基因刺激物(STING)激动剂可激活这种先天免疫通路,在临床前模型中已显示出强大的抗肿瘤活性。然而,临床试验并未在患者身上复现这些效果,这凸显了转化差距,以及需要更好地理解影响人类癌症中STING通路激活的调控机制和耐药因素。
9号染色体短臂21.3区(9p21.3)在多种癌症类型中经常发生纯合性缺失,该区域包含甲基硫腺苷磷酸化酶(MTAP)基因以及邻近的基因位点,如细胞周期蛋白依赖性激酶抑制剂2A(CDKN2A)、CDKN2B,在某些情况下还包括IFN-I基因簇。尽管IFN基因簇的共缺失与9p21.3缺失相关的免疫冷表型有关,但是在一项新的研究中,中国研究人员发现,MTAP缺失本身会损害细胞质核酸感知。对癌症基因组图谱(TCGA)的分析(排除了IFN基因簇纯合缺失的病例)显示,MTAP与IFN-I表达呈正相关。他们还发现MTAP缺失是人类肿瘤的一个常见特征,而在标准小鼠模型中基本不存在。这些观察结果共同使我们提出假设:MTAP缺陷会从内部抑制核酸感知,并导致对STING激动剂的耐药性。
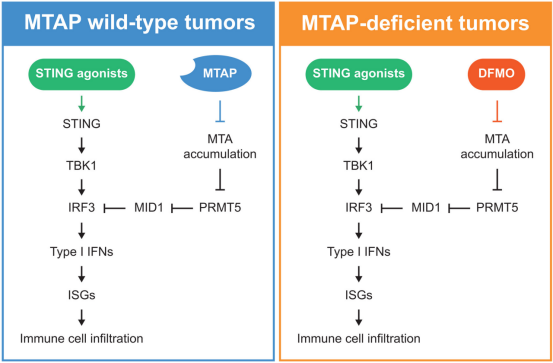
通过使用多个同基因细胞系模型,他们发现MTAP缺失通过下调核酸感知中的关键转录因子——干扰素调节因子3(IRF3)——来抑制IFNβ及其下游ISG的诱导。从机制上讲,MTAP缺失导致其底物甲基硫腺苷(MTA)积累,MTA会抑制甲基转移酶蛋白精氨酸甲基转移酶5(PRMT5)的活性。在MTAP完整的细胞中,抑制或敲低PRMT5同样会降低IRF3表达并损害核酸感知,这确立了PRMT5作为IRF3的正向调节因子。MTA也会被分泌出来,并可以抑制邻近MTAP正常细胞中的PRMT5活性和IRF3,从而形成一种旁分泌免疫抑制环境。他们进一步鉴定出E3泛素连接酶Midline-1(MID1)在MTAP缺陷、PRMT5被抑制或PRMT5耗竭的细胞中表达上调,而MID1会靶向IRF3使其降解。PRMT5通过在其启动子区沉积组蛋白H4第3位精氨酸对称二甲基化(H4R3me2s)这一抑制性组蛋白标记来抑制MID1;MTAP缺陷则废除了这种调控,导致MID1增加和IRF3去稳定化。使用美国FDA批准的鸟氨酸脱羧酶抑制剂DL-α-二氟甲基鸟氨酸(DFMO)进行治疗,可降低MTA水平,恢复PRMT5活性,抑制MID1,并在MTAP缺陷细胞中挽救IRF3水平和核酸感知能力。在同系小鼠肿瘤模型中,MTAP缺陷的肿瘤对STING激动剂耐药。然而,STING激动剂与DFMO的联合治疗克服了这种耐药性,引发了强劲的抗肿瘤反应并增加了免疫细胞浸润。
8.亲完它就缩着跑?!Science:我国科学家破解百年神经通信争论
DOI: 10.1126/science.ads7954
我们的每一次思考、感知和动作,都离不开大脑中神经元之间的 “悄悄话”,而传递这些 “悄悄话” 的关键,就是突触囊泡(SV)。这些微小的 “神经快递员” 会装载神经递质,在动作电位触发下与突触前膜融合、释放内容物,完成神经元间的信号传递。
可几十年来,科学家们一直争论一个关键问题:这些 “快递员” 完成投递后,是短暂 “亲吻” 膜就离开(“即吻即离” 模型),还是彻底融入膜中(“完全坍塌” 模型)?
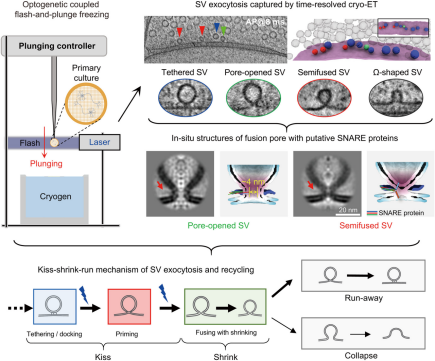
如今,中国科学技术大学陶昌路、毕国强团队联合深圳先进技术研究院、美国加州大学洛杉矶分校周正洪团队,用一项 “时空双精” 的技术破解了这个难题。他们开发出时间分辨细胞冷冻电子断层扫描(cryo-ET)技术——既能在纳米尺度看清囊泡的 3D 结构,又能以毫秒级精度捕捉动态过程。实验中,研究人员给培养的大鼠海马神经元装上 “光控开关”(转染 ChIEF 通道视紫红质蛋白),用激光触发动作电位后,在 0 到 300 毫秒内精准冷冻突触,最终拍下了 1000 多张完整兴奋性突触的 “高清动态图”。
在突触前的 “活跃区”(神经递质释放的关键区域),研究团队首先发现了两类 “快递员”:直径约 29 纳米的 “小囊泡” 和 41 纳米的 “大囊泡”,它们还能分成七种状态——锚定(大 / 小)、半融合(大 / 小)、孔开放(大 / 小)和 Ω 形(仅小囊泡)。更关键的是,当用药物(CNQX)让神经网络 “休眠” 后,小囊泡数量明显减少;而用破伤风毒素(TeNT)切断 SNARE 蛋白(帮助囊泡与膜融合的 “分子胶水”)后,小囊泡直接消失了,这说明小囊泡的形成离不开正常的神经活动和融合机制。
接下来的 “动态电影” 更令人惊叹:静息时,大囊泡像 “待命快递员” 一样锚在突触前膜上(对接状态);动作电位触发后 4 毫秒内,它们就变成 “半融合状态”——像轻轻 “亲吻” 了一下膜(预置步骤);很快,这些 “亲吻” 的地方会形成一个约 4 纳米的 “小通道”(脂质融合孔),孔的两侧还能看到 SNARE 复合物的痕迹,神经递质就是从这个 “通道” 里释放出去的。更神奇的是,释放完的大囊泡会迅速 “瘦身”,表面积缩到原来的一半,变成小囊泡;到 70 毫秒时,大部分 “瘦身” 后的小囊泡会从膜上脱离(“跑离” 步骤),只有少数会彻底融入膜中;100 毫秒后,“跑离” 的小囊泡会移到囊泡簇的外围,而之前被撑开的突触前膜,则通过 “超速内吞作用” 快速回收。整个过程像一套精密的 “纳米级流水线”。
9.生育力下降别只怪卵子!Science:卵巢里的神经、胶质细胞才是“隐形操控者”
DOI: 10.1126/science.adx0659
35 岁后怀孕难” 几乎成了当代女性的生育焦虑标签——从 25 岁到 40 岁,女性每月成功受孕的几率会急剧下滑。几十年来,科学家们都默认 “卵子老了、坏了” 是罪魁祸首,但加州大学旧金山分校(UCSF)和陈・扎克伯格生物中心旧金山分校的新研究,却给这场 “生育困局” 提供了全新答案:卵巢衰老不只是卵子的 “独角戏”,周围的 “生态系统”,包括支持细胞、神经甚至结缔组织,都在悄悄影响卵子成熟,加速生育力衰退。
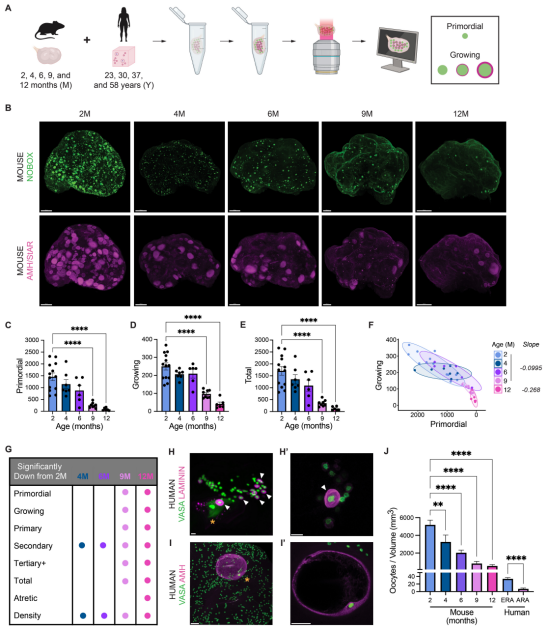
该研究的通讯作者、UCSF 妇产科与生殖科学系教授 Diana Laird 博士直言:“我们以前总把卵巢衰老简化成‘卵子数量少了、质量差了’,但这次研究清楚地看到,卵子周围的每一寸环境都在变——包裹卵子的颗粒细胞、调节生长的神经、维持结构的结缔组织,都会随年龄发生改变。” 而理解这些变化,不止关乎 “能不能生”,更关乎 “老得健不健康”:要知道,女性绝经或切除卵巢后,心血管疾病、骨质疏松等老年病风险会飙升,若能减缓卵巢衰老,或许能帮我们延缓这些疾病的到来。
为了摸清卵巢衰老的 “全貌”,研究团队先从 “可视化” 入手。他们开发了一种全新的三维(3D)成像技术:给完整的小鼠卵巢做 “整体免疫染色” 并透明化处理,不用像过去那样把卵巢切成薄片,就能清晰看到卵子的分布和状态。
结果发现,2-4 月龄的小鼠(对应人类 20 岁出头)卵巢里,卵子还能均匀分布;可到了 9-12 月龄(对应人类 35-45 岁,即医学上的 “高龄生育期”),不仅储备的原始卵泡(未成熟的 “卵子后备军”)在 6 月龄前缓慢减少、12 月龄时急剧下降,就连正在生长的卵泡,也从 4 月龄开始悄悄减少。更关键的是,这些 “高龄小鼠” 做体外受精(IVF)时,排卵数量会减少,卵子能发育成囊胚的概率也显著降低——这和 35 岁后女性的生育困境几乎一模一样。
当团队把这种 3D 技术用到人类卵巢上时,还发现了一个意外现象:人类的卵子并非均匀散布在卵巢里,而是像 “小社区” 一样,聚集在皮质区的 “卵泡口袋” 里,周围全是没有卵子的 “空白区”。而且年龄越大,这些 “口袋” 里的卵子密度越低,口袋本身的体积也越小。“这完全超出了我们的预期,”Laird 说,“我们原本以为卵子会像‘撒种子’一样分布,可‘口袋’的存在说明,就算在同一个卵巢里,环境不同,卵子的存活和成熟能力也会不一样。”
DOI: 10.1126/science.adr7403
大脑中的神经元通过突触相互交流——这些连接点允许电信号和化学信号传递。在非神经元细胞中,已发现细胞间的直接连接是在纳米管结构的辅助下完成的。特别是,隧道纳米管(tunneling nanotubes, TNTs)在某些细胞类型中展现了物质交换功能。这些TNTs在大脑的分离神经元中已有记载,但它们在成熟脑神经元中的存在和功能尚不明确。

如今,一组科学家发现了一种新型纳米管,它似乎扮演着一种桥梁的角色,在树突——神经元上分支状的突起之间运输物质。这项发表在《科学》杂志上的研究,描述了该团队所谓的"树突纳米管(dendritic nanotubes, DNTs)"及其与阿尔茨海默病中常见的β-淀粉样肽积累的可能关联。
研究人员首先使用超分辨率显微镜和电子显微镜,在小鼠和人类脑组织中识别出了DNTs。这些富含肌动蛋白的DNTs被发现连接着小鼠和人类大脑皮层的树突。为了将DNTs与其他树突结构区分开来,该团队采用了专门的成像技术和基于机器学习的分析方法。
研究作者写道:"基于机器学习的分类证实,它们的形状与突触结构不同。在培养的神经元中,我们观察到这些纳米管是动态形成的,并确认它们具有独特的内部结构,这使其有别于其他神经元突起。"
这些纳米管的行为也不同于更为人熟知的TNTs。DNTs没有表现出TNTs用于运输物质的隧道行为。相反,它们的末端是封闭的,因此得名略有不同。尽管如此,DNTs确实能够运输物质,如钙离子和小分子。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


