Dev Cell | 周波/邹卫国揭示骨折后骨骼干细胞来源发生转变
来源:生物探索 2024-04-08 10:00
该研究提出靶向成纤维细胞激活可能潜在地改善愈合骨的质量,尽管它可能会延迟愈合过程。
中国科学院分子细胞科学卓越创新中心周波及邹卫国共同通讯(刘逸铭、唐新宇及舒慧是论文的共同第一作者)在Developmental Cell 在线发表题为“Fibrous periosteum repairs bone fracture and maintains the healed bone throughout mouse adulthood”的研究论文,该研究开发了一种系统来区分小鼠形成层骨膜和骨髓中的纤维层骨膜细胞(FL-PCs)和骨干/祖细胞(SSPCs)的命运。
该研究发现FL-PCs不参与稳态成骨,而是在骨折愈合过程中形成纤维软骨骨痂的主体。此外,FL-PCs在骨折后侵入形成层骨膜和骨髓,形成新的SSPCs,在成年期继续维持愈合的骨骼。FL-PCs衍生的neoSSPCs表达的成骨特征基因水平较低,与先前存在的SSPCs相比,其成骨分化活性较低。与此一致的是,愈合的骨头比正常的骨头更薄,形成更慢。因此,纤维骨膜成为骨折后骨的细胞来源,并永久性地改变骨的性质。

骨膜由外层纤维层和内层形成层组成,对骨骼生长和修复至关重要。外层是致密的不规则结缔组织,其已知功能是为骨骼提供结构支撑,并将骨骼和肌肉连接在一起它主要由胶原纤维和成束的分散的细长成纤维细胞组成内层细胞密度较高,含有成骨细胞、破骨细胞和基质细胞通过直接形态学检查,或通过评估H3-胸腺嘧啶或溴脱氧尿苷(BrdU)与DNA的结合,对骨膜细胞增殖的研究表明,增殖细胞主要位于内层。体外培养的骨膜外植体内层仅形成新软骨和成骨细胞,外层仅形成成纤维细胞。因此,内层一直被认为是骨膜的唯一成骨层。
多种解剖上不同类型的骨干/祖细胞(SSPCs)与软骨内骨的维持和修复有关。生长板上的软骨细胞是发育过程中骨骼生长的主要贡献者,而Lepr+骨髓基质细胞(BMSCs)是成年期骨骼维持的主要贡献者。骨膜成骨细胞由骨膜局部SSPCs形成。来自骨髓(BM)和骨膜的SSPCs均参与骨折后骨再生;然而,不同SSPC亚群在骨折愈合过程中的确切分工尚不清楚。
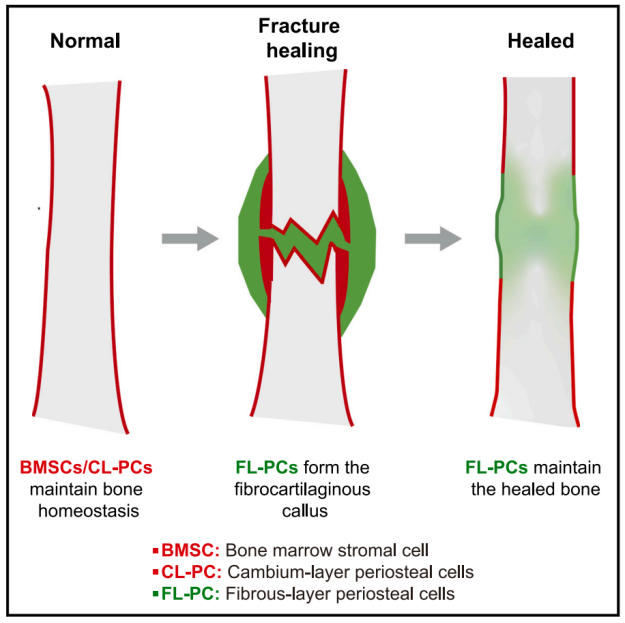
模式图(Credit: Developmental Cell)
通过遗传谱系追踪确定SSPC功能的一个主要挑战是,单个基因似乎不足以特异性标记纯骨骼干细胞或基质细胞群。用于标记骨髓间充质干细胞的Cre等位基因经常标记一些骨膜间质细胞(PSCs),反之亦然,使追踪数据的解释复杂化。骨膜的外层和内层从来没有基因上的分离。
采用Pdgfra-CreER 和Osx-Dre的正交组合,作者开发了SSPC同步示踪系统(SSPC simultracer)来区分骨髓间质干细胞、形成层骨膜细胞(CL-PCs)和纤维层骨膜细胞(FL-PCs)的命运。包括Pdgfra+ Osx+细胞,用Tomato标记BM和骨膜内层有SSPCs和骨系,而Pdgfra+ Osx-细胞(ZsGreen标记)在骨膜外层包括成纤维细胞。该研究提出靶向成纤维细胞激活可能潜在地改善愈合骨的质量,尽管它可能会延迟愈合过程。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


