《癌细胞》:南开大学团队揭示乳腺癌细胞“化用”共刺激分子CD28,上调PD-L1表达实现免疫逃逸的机制!
来源:奇点糕 2024-12-17 10:20
南开大学研究者们也是先对TNBC这种典型的免疫冷肿瘤进行体内全基因组CRISPR筛选,专门识别影响免疫逃逸或抗肿瘤应答的关键基因,Cd28才作为候选基因之一被揪了出来。
南开大学免疫学研究所曹雪涛院士团队在Cancer Cell期刊发表的研究成果[1]就显示:T细胞表面常见的经典免疫共刺激分子CD28,竟然会被三阴性乳腺癌(TNBC)细胞“化用”,即癌细胞表达的CD28胞内结构域能与PD-L1编码基因Cd274 mRNA结合,从而上调PD-L1表达水平,促进免疫逃逸并导致免疫耐药,这也实在是太狡猾了吧?
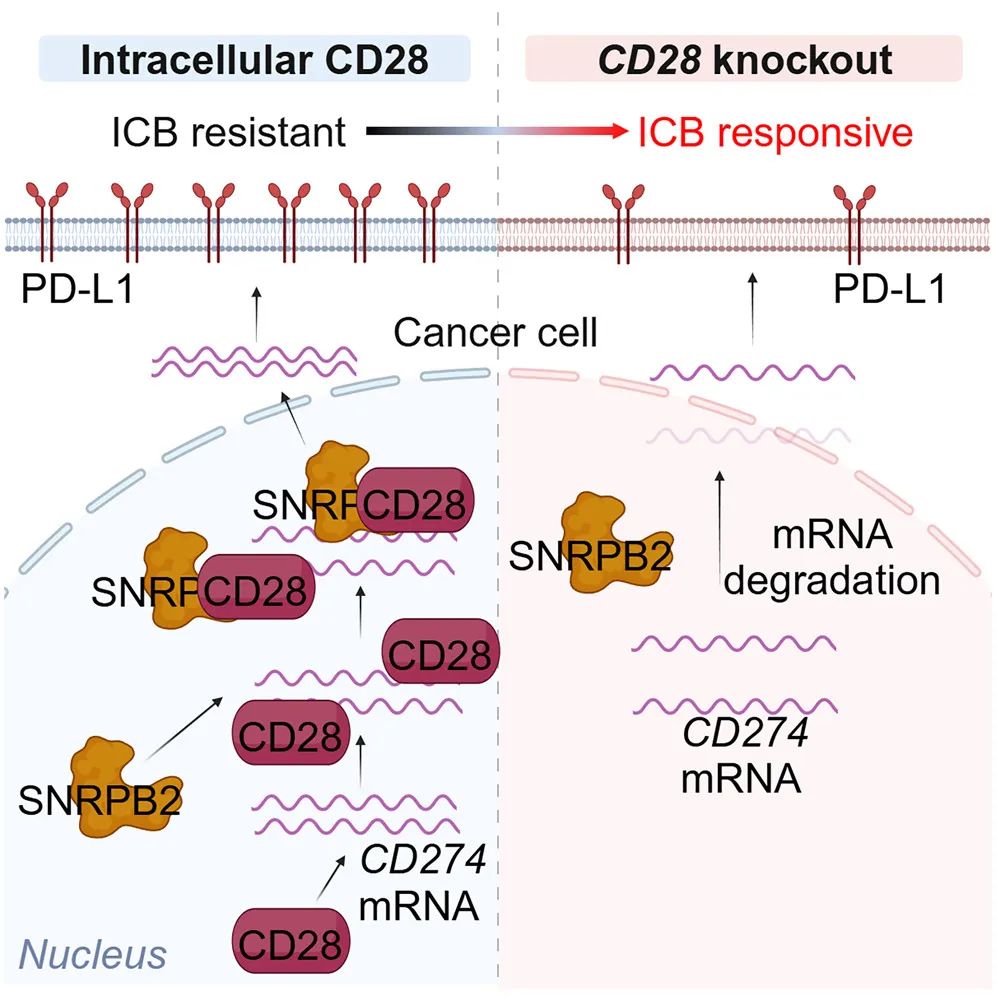
一图总结论文核心内容
关注免疫治疗的读者们肯定都不会对CD28感到陌生,经典的免疫共刺激分子之一嘛,对T细胞从生存到代谢再到功能的方方面面都有重要影响[2]。但长期以来,学界像是默认CD28的版权归T细胞所有一样,并没怎么探索CD28在其它免疫细胞乃至癌细胞中是否存在,更别说是CD28的潜在促癌功能,只能说知识盲区属实有点大了。
而在本次研究中,南开大学研究者们也是先对TNBC这种典型的免疫冷肿瘤进行体内全基因组CRISPR筛选,专门识别影响免疫逃逸或抗肿瘤应答的关键基因,Cd28才作为候选基因之一被揪了出来。由于此前从未有研究报告癌细胞中存在CD28,研究者们还专门通过RNA原位杂交、蛋白质印迹和免疫荧光等多种技术对结论进行了多次验证。
验证出来的发现可就更值得重视了,不只是癌细胞内存在CD28的问题,而且CD28主要处于TNBC细胞的胞浆与细胞核中,与在T细胞的细胞膜表面表达明显不同,这就提示CD28在癌细胞中的功能大概率也是“非经典”的;而敲除Cd28后,TNBC细胞在免疫健全小鼠中就完全无法形成肿瘤,小鼠也能长期生存,这种抑癌效应则主要是CD8+T细胞介导的。
很显然,CD28的存在会使TNBC细胞逃过CD8+T细胞主导的抗肿瘤免疫应答。研究者们还通过回补实验,即分别让TNBC细胞表达CD28蛋白的不同片段证实,CD28的胞内结构域存在与否,才是TNBC细胞能否实现免疫逃逸的关键,下一步探索也就有明确方向了。

CD28胞内结构域介导免疫逃逸
流式细胞术分析显示,敲除TNBC细胞Cd28导致的肿瘤微环境重塑,代表性特征是CD8+T细胞以及1型经典树突状细胞(cDC1s)的数量和占比上升,且CD8+T细胞的IFN-γ、颗粒酶B和穿孔素等关键功能分子表达明显上调,说明被激活进入了战斗力超强的状态,而在体内实验(使用多西环素诱导敲低Cd28)中的发现也基本相同,即敲低TNBC细胞的Cd28不仅可以有效抑癌,还能克服TNBC细胞对PD-1抑制剂治疗的耐药。
那接下来,该揭示CD28导致免疫逃逸的具体机制了:借助单细胞RNA测序,研究者们发现敲除Cd28直接导致了TNBC细胞的PD-L1表达下调;免疫共沉淀实验则显示,CD28主要会与多种RNA结合蛋白(RBPs)发生相互作用,可能借助RBPs影响PD-L1编码基因Cd274 mRNA的稳定性,但其实顺序是CD28的胞内结构域先直接结合Cd274 mRNA,然后再募集RBPs中的小核糖核蛋白多肽B2(SNRPB2)来稳定Cd274 mRNA。
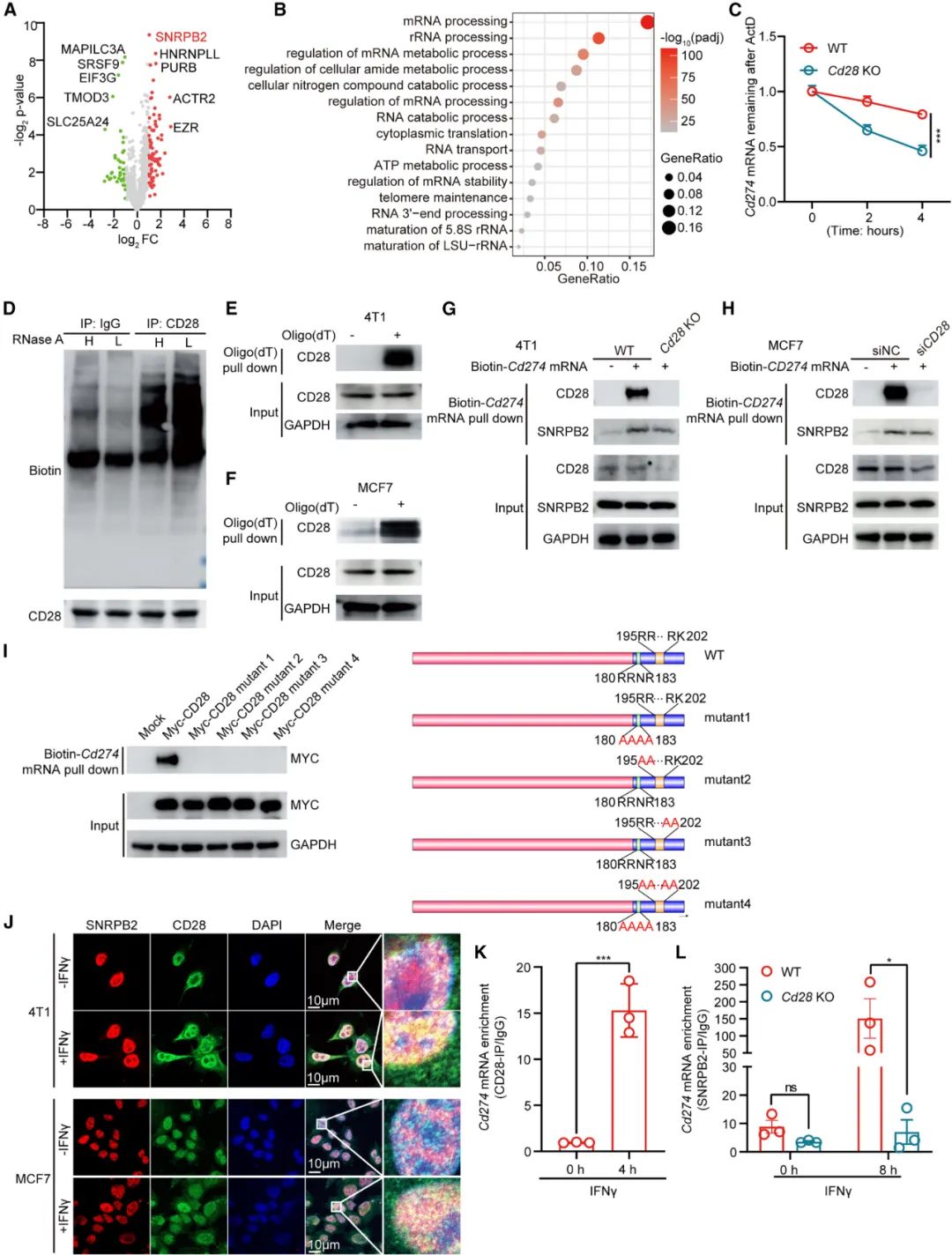
CD28胞内结构域可直接结合Cd274 mRNA,并募集SNRPB2来稳定Cd274 mRNA
通过上述机制,CD28就能够帮癌细胞上调自身PD-L1表达水平、实现免疫逃逸,研究者们最后也分析了不同亚型人类乳腺癌患者的组织样本,证实癌细胞CD28表达水平与PD-L1表达上调、肿瘤内CD8+T细胞浸润减少和患者预后不良相关,且在TNBC中尤为突出,而肺癌样本中竟然也存在CD28表达水平和PD-L1表达的相关性。免疫共刺激分子里竟然会出这么一个“叛徒”,赶紧想办法精准干预吧,最好还能不伤及T细胞。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


