入选年度最佳Cell论文,蔡立慧团队在单细胞层面解析阿尔茨海默病的复杂性
来源:生物世界 2024-01-11 11:21
该封面以瓷砖的形式展示了大脑中脑细胞和基因组的组织系统结构,随着疾病的发展,基因组组织随着神经元退化和小胶质细胞激活而被侵蚀和打乱,反映了阿尔茨海默病对大脑细胞和分子景观的破坏性影响。
Cell期刊同期发表了5篇阿尔茨海默病研究论文,其中4篇来自哈佛大学/麻省理工学院蔡立慧团队,这些研究共同展示了阿尔茨海默病中不同细胞类型在单细胞分辨率的基因组、表观基因组和转录组失调。这些论文还被选为了当期封面论文。
该封面以瓷砖的形式展示了大脑中脑细胞和基因组的组织系统结构,随着疾病的发展,基因组组织随着神经元退化和小胶质细胞激活而被侵蚀和打乱,反映了阿尔茨海默病对大脑细胞和分子景观的破坏性影响。
1、单细胞图谱揭示高认知功能、痴呆和阿尔茨海默病病理的关联

这篇论文入选了“Best of Cell 2023”,成为9篇年度最佳 Cell 论文之一。
论文题目:Single-cell atlas reveals correlates of high cognitive function, dementia, and resilience to Alzheimer’s disease pathology
通讯作者:蔡立慧、Manolis Kellis
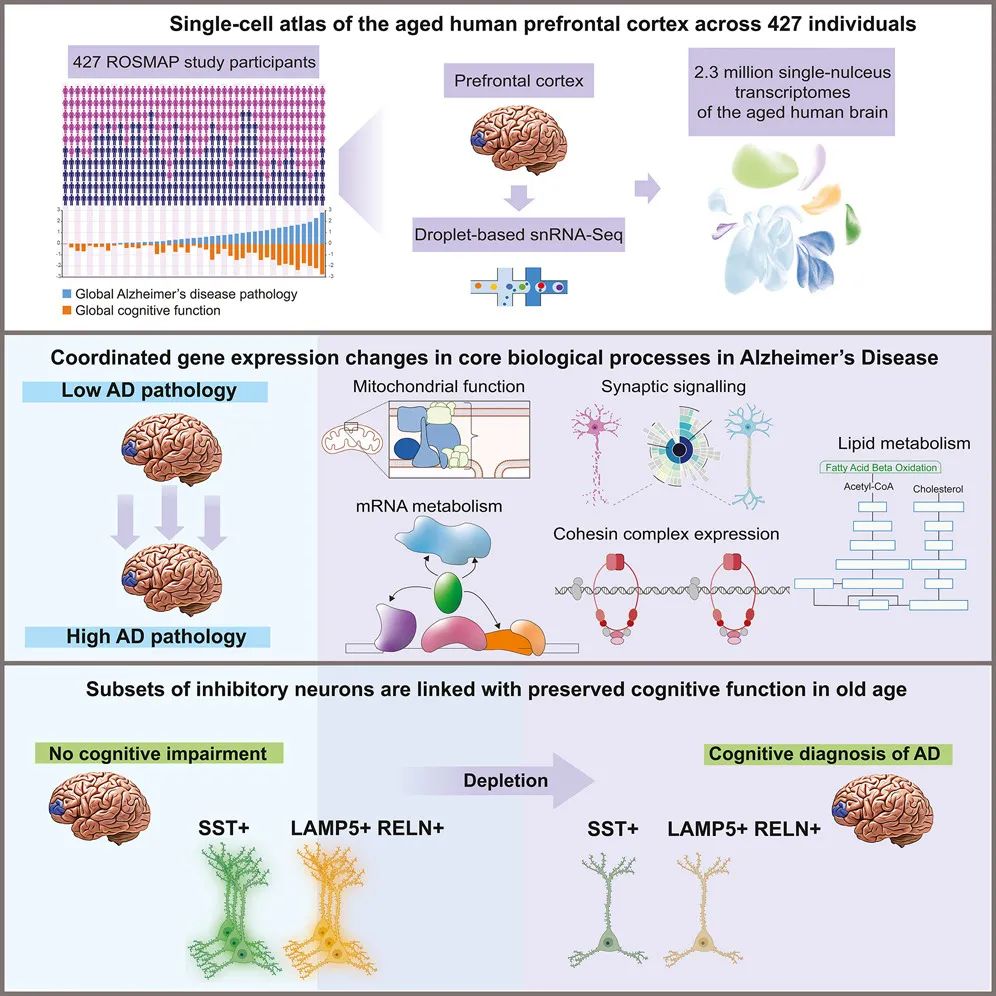
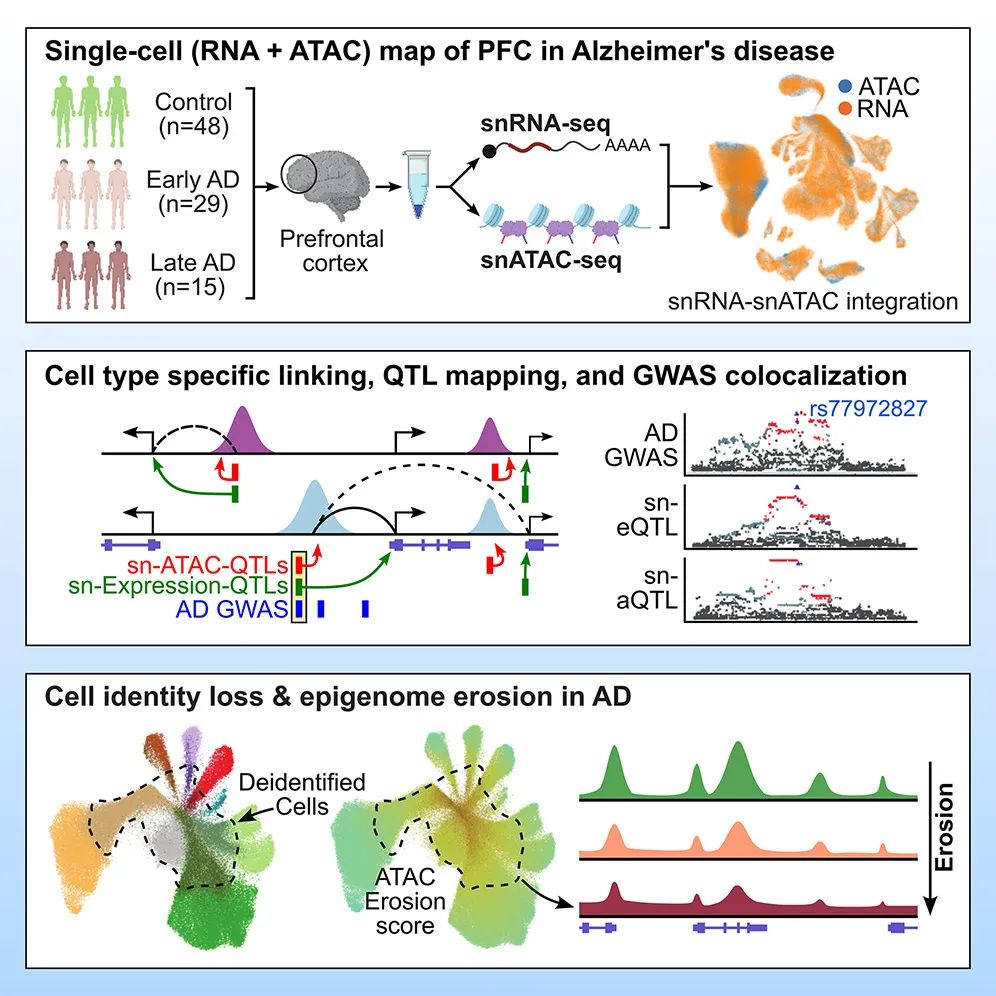
阿尔茨海默病(AD)是全球痴呆症最常见的原因,但认知障碍的分子和细胞机制仍然不为人所知。为了解决这个问题,该研究生成了老年人前额叶皮层的单细胞转录组图谱,覆盖了427名不同程度AD病理和认知障碍患者死后人脑样本中的230万个细胞。
这项研究分析确定了兴奋性神经元亚型之间共享的AD病理相关改变,揭示了兴奋性神经元和少突胶质细胞中凝聚素复合物和DNA损伤反应因子的协调增加,并发现了与高认知功能、痴呆和对AD病理的适应性相关的基因和通路。此外,该研究还确定了在AD中选择性损耗的生长抑素抑制神经元亚型,发现了两组不同的抑制神经元,它们在晚年保持高认知功能的个体中更为丰富,并发现了抑制性神经元和对AD病理的适应性之间的联系。
2、神经元DNA双链断裂导致神经退行性疾病中基因组结构变异和三维基因组混乱

论文题目:Neuronal DNA double-strand breaks lead to genome structural variations and 3D genome disruption in neurodegeneration
通讯作者:蔡立慧、Manolis Kellis
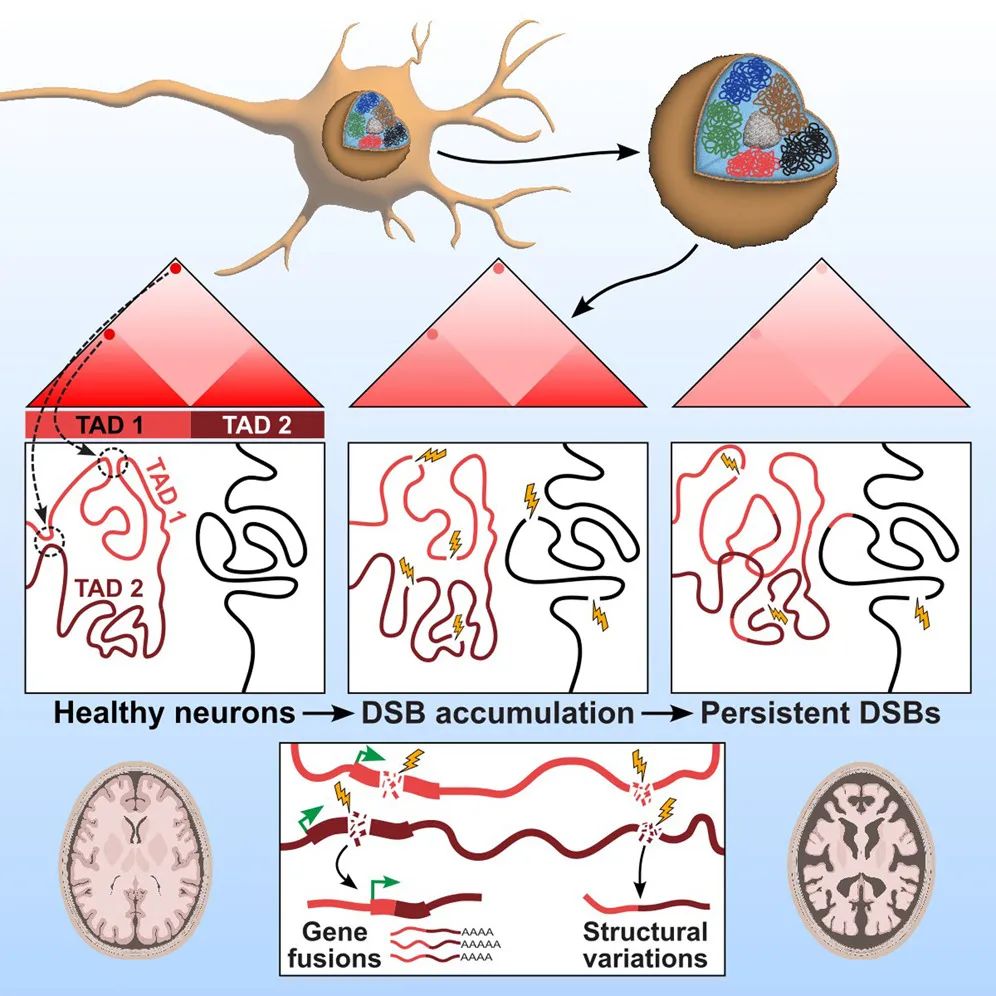
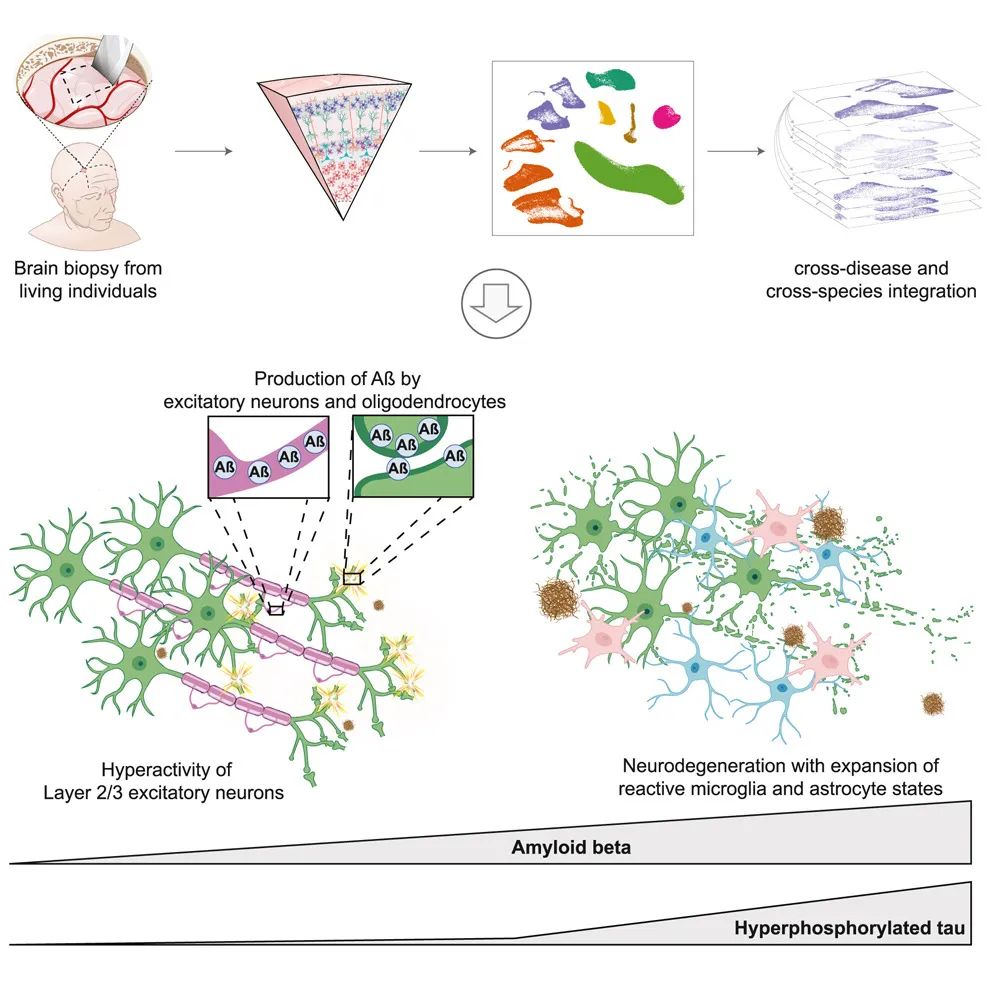
神经元中持久的DNA双链断裂(DSB)是包括阿尔茨海默病(AD)在内的神经退行性疾病的早期病理标志,具有破坏基因组完整性的潜力。
该研究使用单核RNA-seq在阿尔茨海默病患者死后捐献的前额叶皮层样本中发现,AD中的兴奋性神经元富集了体细胞镶嵌基因融合,基因融合特别富集在具有DNA损伤修复和衰老基因特征的兴奋性神经元中。此外,在神经退行性疾病的CK-p25小鼠模型中,体细胞基因组结构变异和基因融合在存在DSB的神经元中富集。富集DSB的神经元还具有较高的凝聚素水平,伴随着与突触、神经元发育和组蛋白基因转录变化相一致的3D基因组组织的渐进性多尺度破坏。总之,该研究证明了神经元中DSB对基因组稳定性和3D基因组组织的破坏,是神经退行性疾病进展中的病理步骤。
3、人类小胶质细胞状态动态在阿尔茨海默病进展中的作用

论文题目:Human microglial state dynamics in Alzheimer’s disease progression
通讯作者:Manolis Kellis、蔡立慧
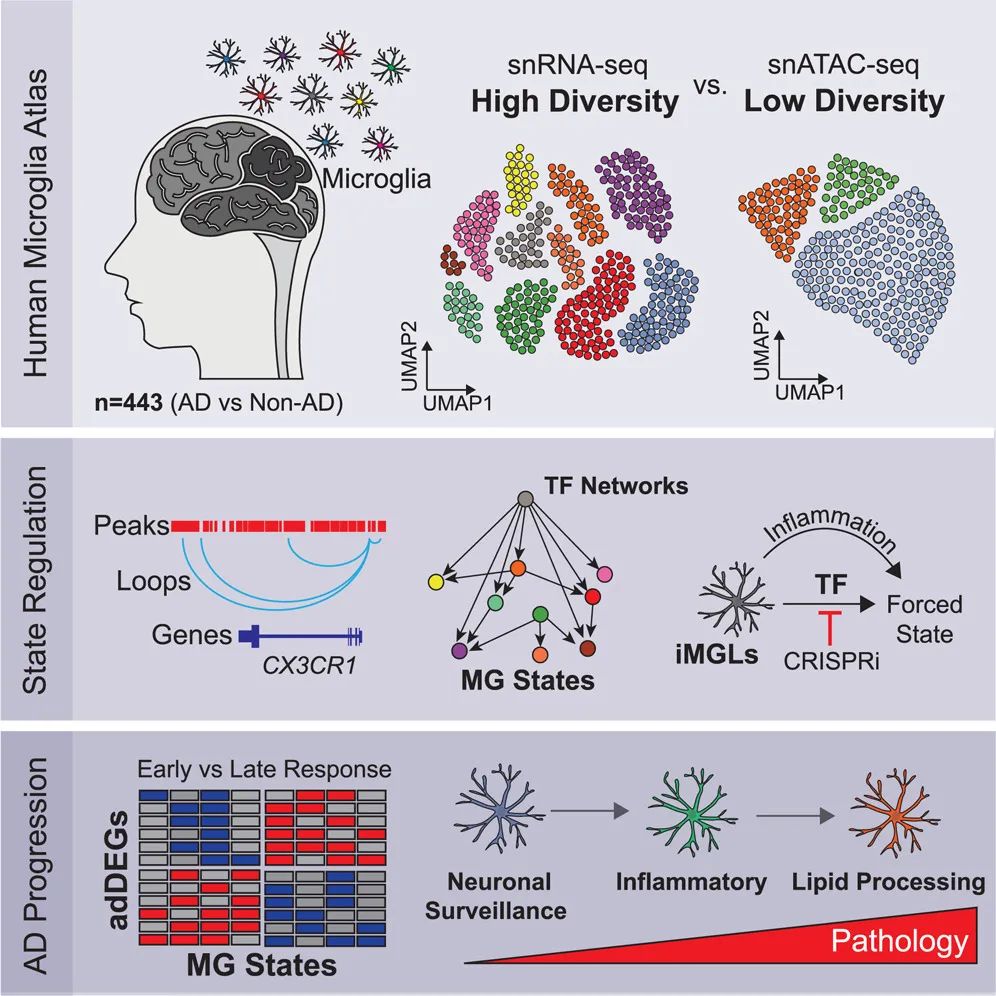
小胶质细胞状态改变会影响神经炎症、神经退行和疾病,但目前仍不清楚。该研究报告了443名人类受试者和不同阿尔茨海默病(AD)病理表型的194000个单核小胶质细胞转录组和表观基因组。
该研究注释了12个小胶质细胞转录状态,包括AD失调的稳态、炎症和脂质处理状态。鉴定了1542个AD差异表达基因,包括小胶质细胞状态特异性和疾病阶段特异性改变。通过整合表观基因组、转录组和基序信息,该研究推断了小胶质细胞状态的上游调节因子、基因调控网络、增强子基因链接和转录因子驱动的小胶质细胞状态转换。该研究还证明了研究中预测的稳态激活因子的异位表达诱导了人诱导多能干细胞(iPSC)来源的小胶质样细胞的稳态特征,而抑制炎症激活因子可以阻止炎症进展。
最后,该研究确定了AD风险基因在小胶质状态中的表达,以及AD进展过程中AD风险基因及其调节因子的差异表达。总之,该研究提供了小胶质状态的潜在见解,包括状态特异性和AD分期特异性的小胶质细胞的改变。


版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


