2024年具有里程碑意义的临床研究TOP10
来源:医药魔方 2025-01-02 10:22
特别筛选了2024年度10项具有“里程碑意义”的临床研究,供大家参考。
创新药临床开发的高风险是业内共识,但即便如此,制药企业还是在坚守挺进,每年都倾注大量资源开展一项项临床研究。重注之下,也有不少新药传来试验成功的捷报。
这些临床结果推动了各种疾病不断向前突破,治疗格局不断焕新,给患者带来了更多宝贵的希望。医药魔方特别筛选了2024年度10项具有“里程碑意义”的临床研究,供大家参考。
2024年具有里程碑意义的临床研究TOP10
NO.1 度伐利尤单抗 EMERALD-1研究
公司:阿斯利康
里程碑意义:靶向+免疫+介入三联疗法在中晚期肝细胞癌中首次得到验证
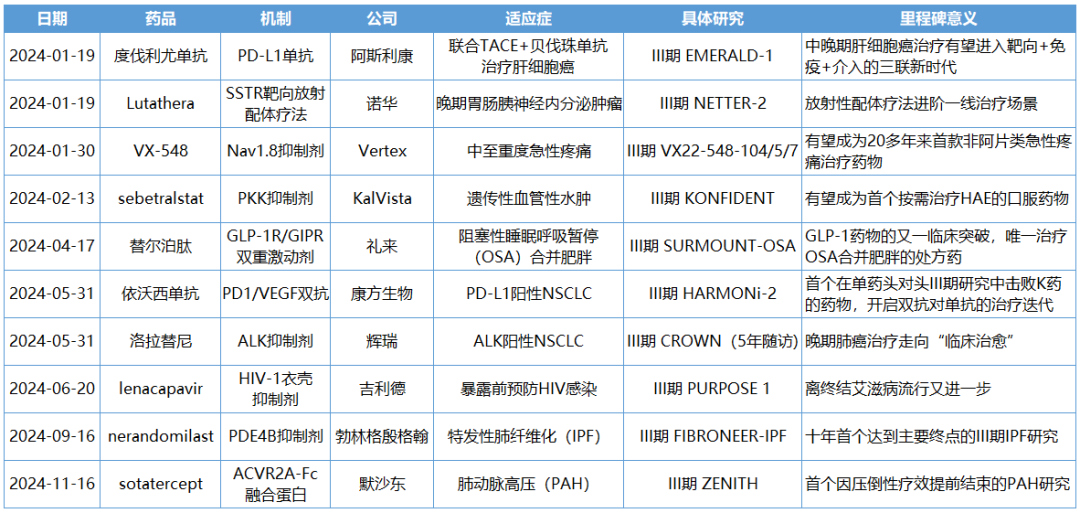
1月19日,阿斯利康宣布度伐利尤单抗(Imfinzi)联合经动脉化疗栓塞术(TACE)和贝伐珠单抗治疗适合栓塞的肝细胞癌(HCC)患者的III期EMERALD-1研究获得了积极结果。
在主要终点无进展生存期(PFS)方面,与单独进行TACE相比,度伐利尤单抗联合治疗组显示出具有统计学意义和临床意义的改善。度伐利尤单抗联合治疗组中位PFS为15个月,而TACE治疗组的中位PFS为8.2个月。观察到的PFS益处在预先指定的关键亚组中基本一致。
与单独进行TACE相比,度伐利尤单抗联合治疗可使疾病进展或死亡风险降低23%(风险比[HR]:0.77;95%置信区间[CI] 0.61-0.98;p=0.032)。
肝细胞癌是最常见的肝癌类型,大约20%-30%的肝细胞癌患者有资格进行栓塞(TACE)治疗。TACE是一种阻断肿瘤血液供应的手术,这种手术也可以直接向肝脏提供化疗或放射治疗。尽管在这种情况下,TACE是标准的治疗方法,但大多数接受TACE治疗的患者会在8个月内出现疾病进展或复发。
EMERALD-1研究是首项评估TACE联合靶免治疗肝细胞癌获得积极结果的全球III期研究,这意味着中晚期肝细胞癌治疗有望进入靶向+免疫+介入的三联新时代。
毫无疑问,三联疗法治疗肝细胞癌是一个有价值的探索方向,还有更多的企业在布局。今年4月,康方登记了CTLA4/PD1双抗卡度尼利单抗+仑伐替尼+TACE治疗对比TACE治疗肝细胞癌的III期研究(NCT06371157),预计将于2025年10月完成主要终点PFS的评估。
9月的ESMO大会上,K药的III期LEAP-012研究闪亮登场,结果显示,K药+仑伐替尼+TACE治疗相较于单独TACE治疗取得了显著的PFS获益(14.6 vs 10.0个月)。
NO.2 Lutathera NETTER-2研究
公司:诺华
里程碑意义:放射性配体疗法跻身一线治疗
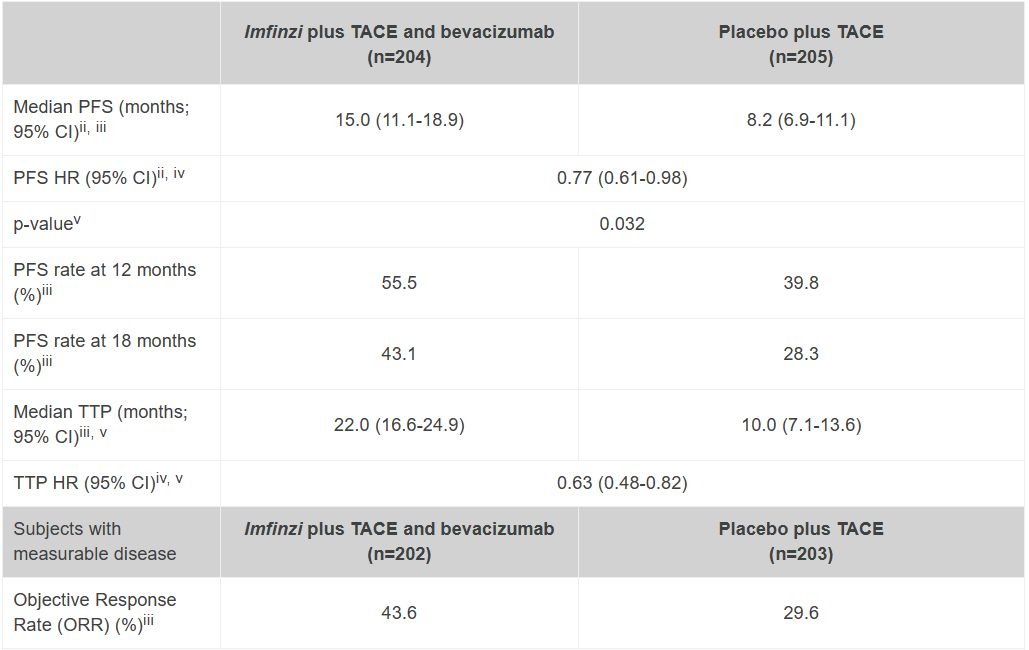
1月19日,诺华公布了其首创生长抑素受体(SSTR)靶向的放射性配体疗法Lutathera的III期NETTER-2试验数据,与单独使用高剂量长效释放奥曲肽相比,Lutathera联合长效奥曲肽一线治疗可将SSTR阳性高分化2级和3级晚期胃肠胰神经内分泌肿瘤(GEP-NETs)患者的疾病进展或死亡风险降低72%。Lutathera成为首个在一线治疗中显示出临床意义获益的放射性配体疗法,也是在GEP-NETs治疗中总体疗效和安全性最佳的疗法。
在III期NETTER-2试验中,Lutathera联合奥曲肽显著延长新诊断的2级和3级晚期GEP-NETs患者的中位PFS至22.8个月,而高剂量奥曲肽单药组的中位PFS为8.5个月。
神经内分泌肿瘤(NET)是一种起源于全身神经内分泌细胞的癌症,通常被认为是生长缓慢的恶性肿瘤。然而,有些NET进展迅速,预后不良,在许多情况下,直到患者病情发展到晚期才被确诊。尽管NET是一种罕见疾病,但其发病率在过去30年中增长了500%以上,因此迫切需要为新确诊的无法手术或晚期患者提供更多的治疗方案。
Lutathera已于2018年获得FDA批准上市,治疗SSTR阳性GEP-NETs成年患者,又于今年拓展适用人群,可用于12岁及以上儿童。2023年,Lutathera全年销售额为6.05亿美元,今年前三个季度销售额为5.34亿美元。
诺华作为核药领域的领导者,结合内外部创新快速搭建起了相关技术平台,打造出Lutathera、Pluvicto两款畅销产品,更多潜力管线也在推进中。瞄准SSTR2靶向放射性配体疗法的开发,诺华于今年11月与Ratio Therapeutics达成了全球独家合作。
NO.3 VX-548 3项III期研究
公司:Vertex
里程碑意义:有望成为20多年来首款治疗急性疼痛的新机制药物
1月30日,Vertex Pharmaceuticals(福泰制药)公布了其潜在首创NaV1.8抑制剂VX-548(suzetrigine)治疗中至重度急性疼痛的III期项目的积极结果。该III期项目包括3项III期研究(VX22-548-104、VX22-548-105和VX22-548-107)。
VX22-548-104(NAVIGATE 1,n=1073)和VX22-548-105(NAVIGATE 2,n=1118)是两项随机、双盲、安慰剂对照、关键临床试验,其中前者针对的人群为拇外翻矫正术患者,后者针对的人群则是腹壁整形术患者。这也是急性疼痛领域迄今为止最大规模的III期随机对照研究。
在104和105研究中,相较于安慰剂组,VX-548组患者在主要终点0-48小时疼痛强度时间加权总和(SPID48)方面有统计学意义的改善,表现为VX-548组患者第48小时的数值疼痛评定量表(NPRS)评分相较基线有临床意义的下降。
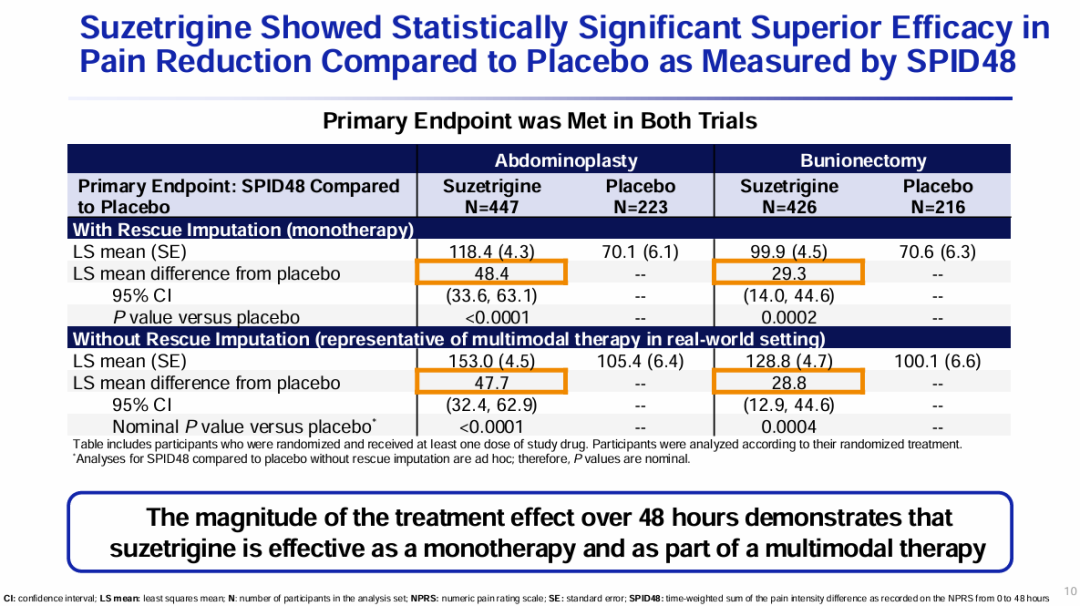
两项研究的关键次要终点——有意义的疼痛缓解时间(即与安慰剂组相比,NPRS评分较基线降低≥2分的时间)顺利达到。不过,104和105研究均未达到VX-548在SPID48方面优效于双酒石酸氢可酮/对乙酰氨基酚(HB/APAP)的另一关键次要终点。
VX22-548-107(n=256)是一项单臂临床试验,招募的人群包括手术和非手术疼痛患者。在107研究中,通过患者整体评估(PGA)衡量治疗效果,83.2%的患者将VX-548评为治疗疼痛良好、非常好或优秀。
VX-548是一种非阿片类、无成瘾性的选择性疼痛信号抑制剂,有望成为20多年来首个治疗中度至重度急性疼痛的新型药物。
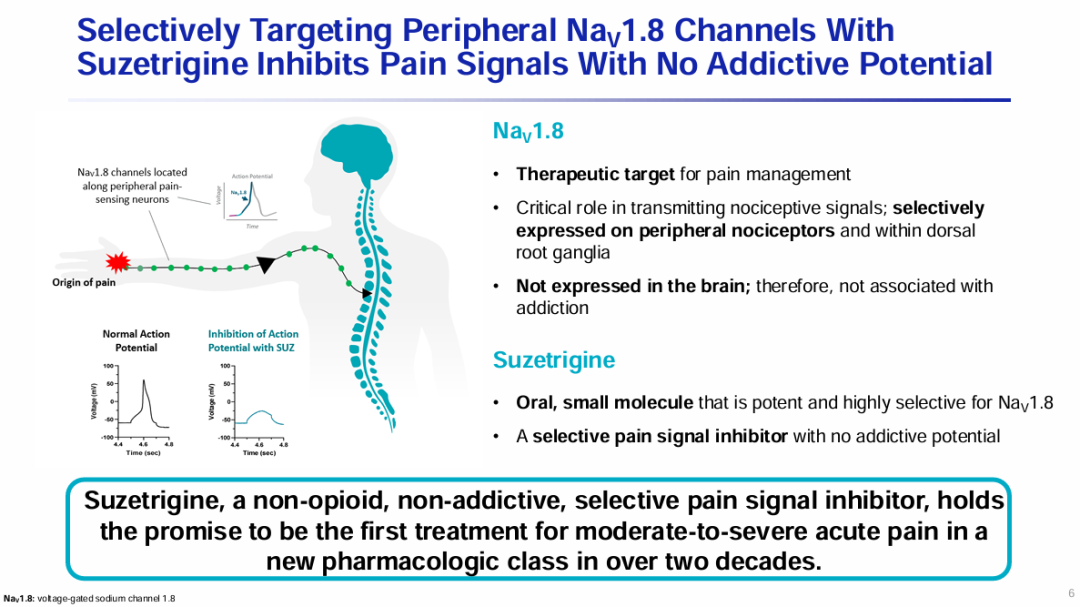
Vertex认为,VX-548靶向的NaV1.8是疼痛治疗的理想靶点。一方面,NaV1.8在传递痛觉信号中起关键作用,选择性表达于外周痛觉感受器和背根神经节内;另一方面,该靶点不在大脑中表达,因此不会导致成瘾。而阿片类止痛药的最大风险就是有成瘾性。
也正是因为相当看好该靶点的潜力,Vertex大举投入了NaV1.8抑制剂的研发,经历VX-128、VX-150、VX-961多番试错仍坚持继续探索。
如今VX-548已进入申报上市阶段,申报的适应症为中至重度急性疼痛,PDUFA日期为2025年1月30日。
值得注意的是,VX-548治疗疼痛性腰骶神经根病(LSR)的II期研究尽管也在近期达到了主要终点,疗效却不及预期,治疗组与安慰剂组之间的差异不够显著。而Vertex仍认为VX-548可以在III期LSR研究中获胜,它相信“通过创新临床试验设计可以更好地控制安慰剂效应”。
除VX-548外,Vertex在该赛道还有其他筹码,下一代NaV1.8抑制剂VX-993和VX-973也已进入临床。其中针对VX-993,Vertex不仅计划开发口服剂型,还有静脉输注版本。
NO.4 sebetralstat KONFIDENT研究
公司:KalVista
里程碑意义:有望成为首个按需治疗HAE的口服药物
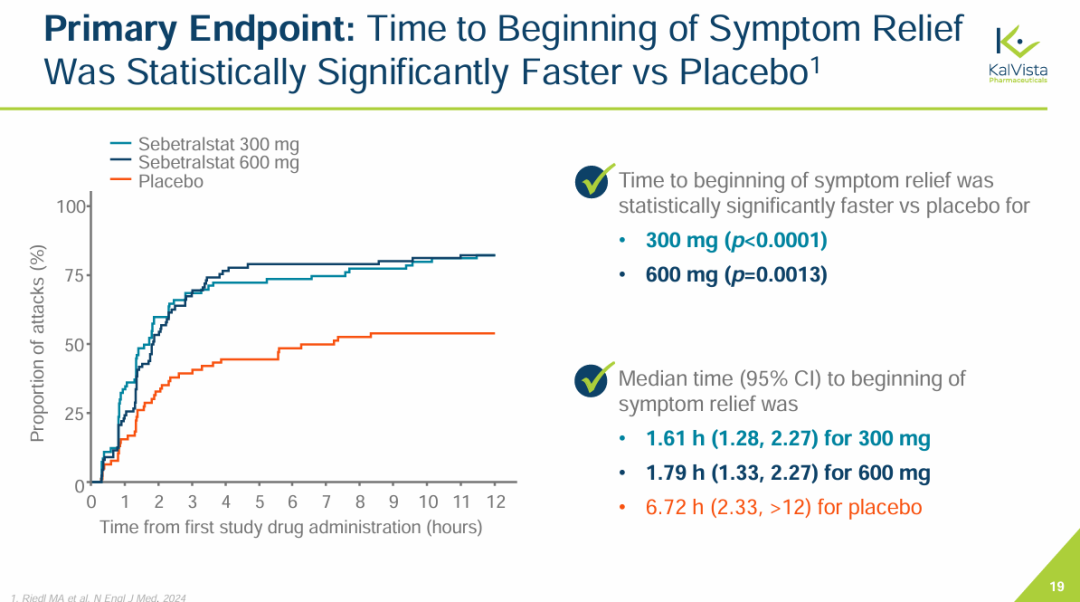
2月13日,KalVista Pharmaceuticals宣布了III期KONFIDENT临床试验的积极结果,表明激肽释放酶(PKK)抑制剂sebetralstat作为口服疗法按需治疗遗传性血管性水肿(HAE)具有显著的统计学和临床疗效。KONFIDENT是迄今为止针对HAE开展的规模最大、最具代表性的试验,试验对象包括青少年、使用长期预防药物的患者以及所有发作严重程度和部位的患者。
KONFIDENT试验达到所有主要和关键次要终点。使用300mg和600mg sebetralstat治疗HAE发作,症状开始缓解的主要终点明显快于安慰剂。sebetralstat 300mg组症状缓解开始缓解的中位时间为1.61小时,sebetralstat 600mg组为1.79小时 ,安慰剂组为6.72小时。
与之前的研究一致,sebetralstat耐受性良好,安全性与安慰剂相似。没有患者因任何不良事件而退出,也没有观察到与治疗相关的严重不良事件(SAE)。300mg sebetralstat组的治疗相关不良事件发生率为2.3%,600mg sebetralstat组为2.2%,安慰剂为 4.8%。
基于上述研究,FDA已受理sebetralstat的上市申请,用于按需治疗成人和12岁及以上青少年的HAE发作,PDUFA日期为2025年6月17日。如果获得批准,sebetralstat将成为第一个按需治疗HAE的口服药物。
HAE是一种罕见的遗传病,会导致C1酯酶抑制物(C1INH)蛋白缺乏或功能障碍,随后激肽释放酶-激肽系统不受控制地激活。HAE患者经历痛苦和虚弱的组织肿胀发作,根据受影响的身体部位,可能会危及生命。
HAE治疗分为急性水肿发作期的治疗(又称按需治疗)、长期预防(LTP)和短期预防(STP)。目前所有获批的按需治疗方案都需要静脉内或皮下给药。因此,安全有效的口服按需治疗对于解决未满足的需求、减轻与注射治疗相关的治疗负担非常有价值。
NO.5 替尔泊肽 SURMOUNT-OSA研究
公司:礼来
里程碑意义:标志GLP-1药物的又一临床突破,也是唯一治疗OSA合并肥胖的处方药
4月17日,礼来宣布其GLP-1R/GIPR双重激动剂替尔泊肽(Tirzepatide,Zepbound)用于治疗中度至重度阻塞性睡眠呼吸暂停(OSA)合并肥胖的III期SURMOUNT-OSA临床试验获得积极结果。
OSA是一种与睡眠相关的呼吸障碍,其特征是睡眠时患者上呼吸道完全或部分塌陷,导致呼吸暂停或呼吸不足,并可能导致血氧饱和度降低和/或患者从睡眠中醒来。OSA会导致严重的心脏代谢并发症,包括高血压、冠心病、中风、心力衰竭、心房颤动和2型糖尿病等。
与安慰剂相比,替尔泊肽显著降低了受试者呼吸暂停低通气指数(AHI),达到了主要终点。AHI记录了受试者每小时睡眠中呼吸受限或气流完全阻塞的次数,用于评估OSA的严重程度和治疗结果的有效性。
SURMOUNT-OSA Study 1评估了替尔泊肽在未接受正压通气(PAP)治疗的中度至重度OSA合并肥胖成人患者中的疗效。结果显示,在52周时,替尔泊肽组受试者平均AHI较基线降低了27.4次/小时,而安慰剂组降低了4.8次/小时。
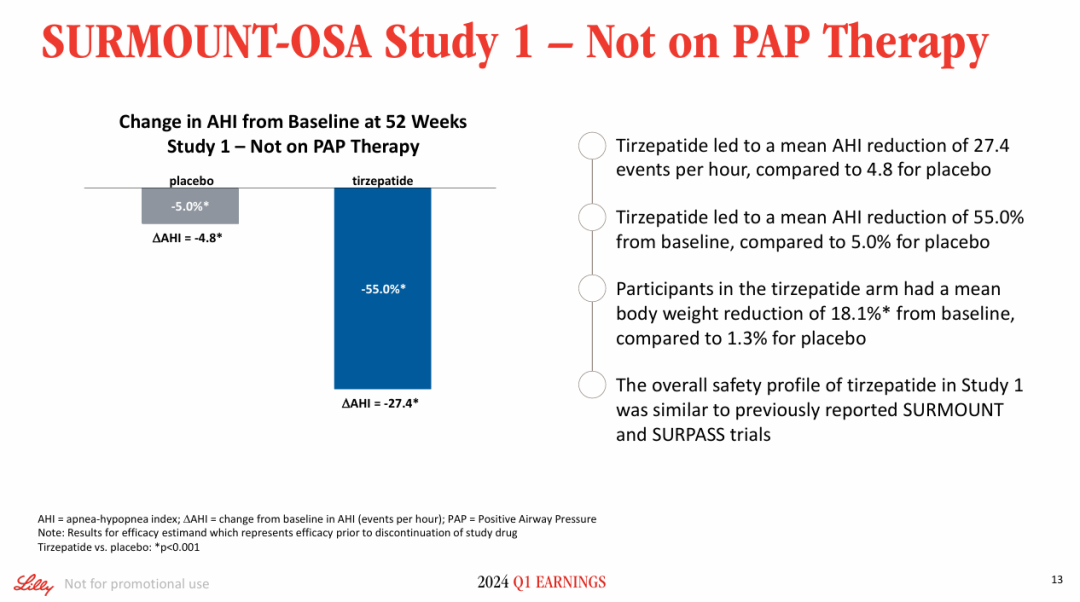
SURMOUNT-OSA Study 2评估了替尔泊肽在接受并计划继续进行PAP治疗的中重度OSA合并肥胖成人中的疗效。结果显示,在52周时,替尔泊肽组受试者平均AHI较基线降低了30.4次/小时,而安慰剂平均降低了6.0次/小时。
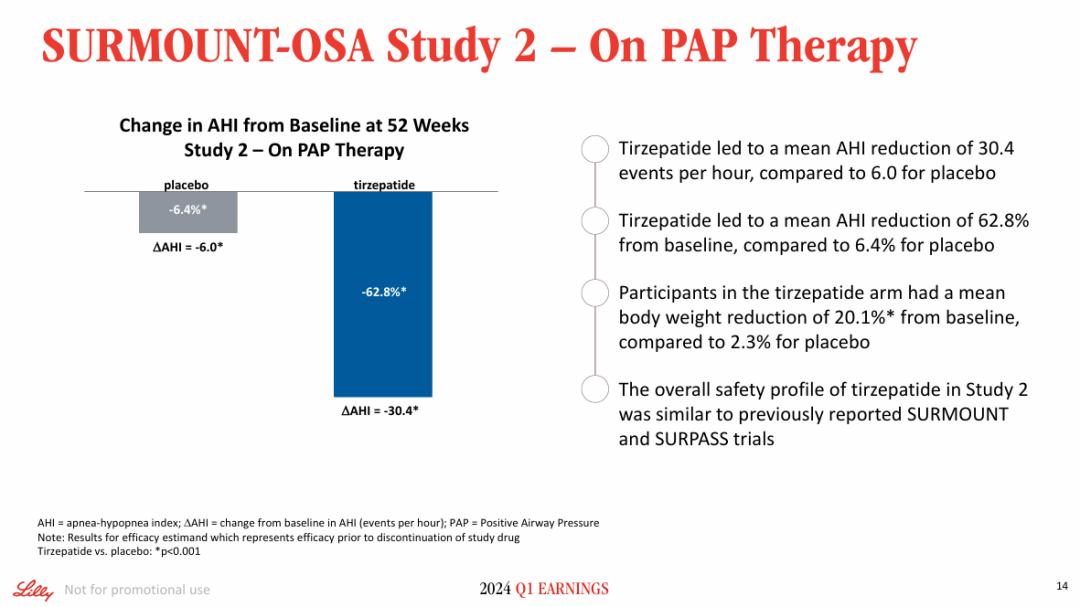
基于此,FDA于今年12月批准了替尔泊肽作为首个也是唯一用于治疗OSA合并肥胖症成人患者的处方药。此次获批意味着GLP-1药物打开了降糖减重之外的又一个市场。
NO.6 依沃西单抗 HARMONi-2研究
公司:康方生物
里程碑意义:首个在单药头对头III期研究中击败K药的药物,明确PD-1药物升级新方向
5月31日,康方生物宣布,全球首创PD-1/VEGF双抗依沃西单抗单药对比帕博利珠单抗一线治疗PD-L1表达阳性(PD-L1 TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)的注册性III期HARMONi-2研究(AK112-303)达到PFS的主要终点。
HARMONi-2研究是全球首个单药疗法对比帕博利珠单抗单药疗法取得显著积极结果的III期临床研究,而帕博利珠单抗已于2023年凭借250亿美元的销售额登顶全球“药王”宝座。该研究共入组398例受试者,其中PD-L1 TPS 1%-49%的受试者占比为57.8%,PD-L1 TPS≥50%的受试者占比为42.2%。
在9月的WCLC大会上,康方生物进一步披露了该研究的数据。在意向治疗人群(ITT)人群中,依沃西组和帕博利珠单抗组的mPFS分别为11.14个月和5.82个月(HR=0.51,P<0.0001),依沃西治疗组疾病进展/死亡风险降低达49%。
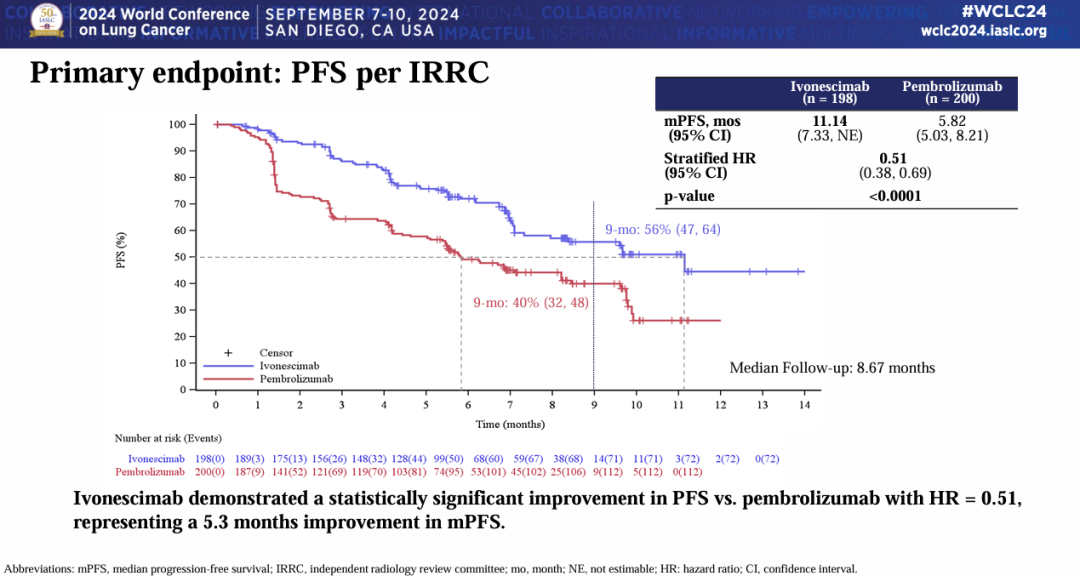
依沃西相比帕博利珠单抗,显著提高了PD-L1阳性NSCLC患者一线治疗的ORR(50.0% vs 38.5%)和DCR(89.9% vs 70.5%)。不过,该研究的OS数据尚未成熟。如果依沃西能在OS方面同样实现获益优势,那么双抗对单抗的治疗迭代将全面开启。
很多海外企业已提前布局,这也给了国产PD-1/VEGF双抗走向全球舞台的机会。在HARMONi-2研究告捷后,Instil引进了宜明昂科的IMM2510,帕博利珠单抗在手的默沙东似乎也有了危机感,以超32亿美元拿下礼新医药的LM-299,BioNTech收购普米斯或许也有PM8002资产加成的因素。
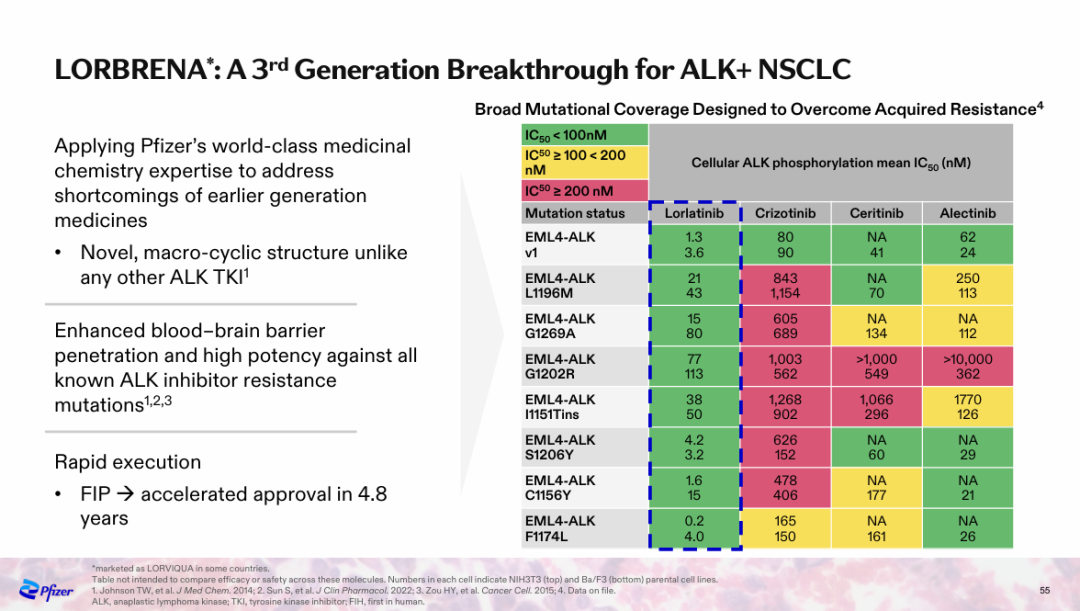
NO.7 洛拉替尼 CROWN研究
公司:辉瑞
里程碑意义:晚期ALK阳性肺癌治疗走向“临床治愈”
5月31日,在ASCO大会上,辉瑞以口头报告的形式公布了III期CROWN研究的长期随访结果。这项研究旨在评估第三代ALK抑制剂洛拉替尼对比第一代ALK抑制剂克唑替尼在既往未经治疗的ALK阳性晚期NSCLC患者中的疗效。
经过五年的中位随访,根据研究者的评估,洛拉替尼治疗组中位PFS仍未达到。这是ALK阳性NSCLC领域有史以来最长的PFS,同时也创下了单药靶向治疗晚期肺癌的最长PFS记录。与克唑替尼相比,洛拉替尼将患者的疾病进展或死亡风险降低了81%。
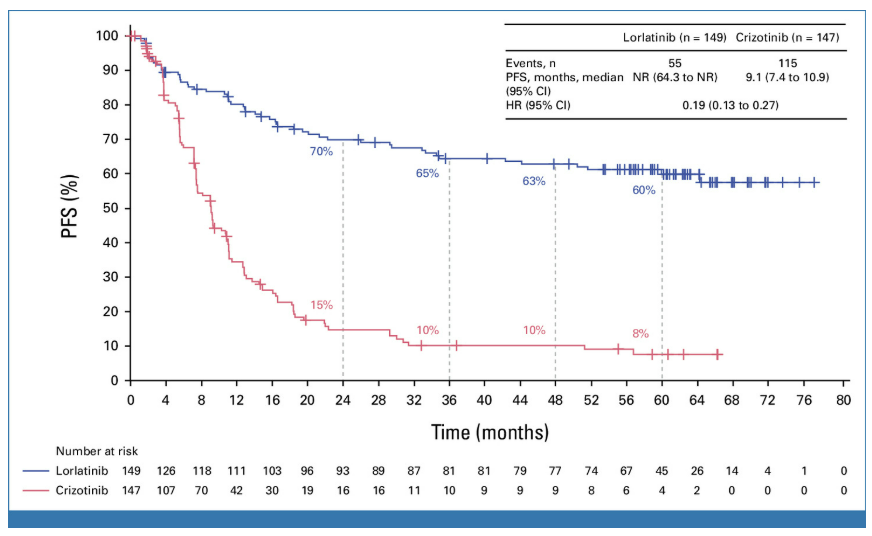
洛拉替尼组的5年PFS率为60%,也就是说,有60%的患者五年后仍未见疾病进展或死亡,而克唑替尼组为8%。“五年后未见疾病进展或死亡”,也意味着这些晚期患者走向了“临床治愈”。
针对脑转移患者,洛拉替尼的疗效进一步凸显。此次更新分析显示,洛拉替尼将患者颅内疾病进展风险降低94%。洛拉替尼组的中位颅内进展时间尚未到达,而克唑替尼组的这一数据为16.4个月。
洛拉替尼取得的非凡治疗效果,印证了辉瑞分子设计策略的正确性。辉瑞将洛拉替尼设计成独特的大环结构,带来了更好的亲脂性以及深度的靶点结合,进而增强血脑屏障渗透性并提高对其他ALK抑制剂耐药突变的效力。
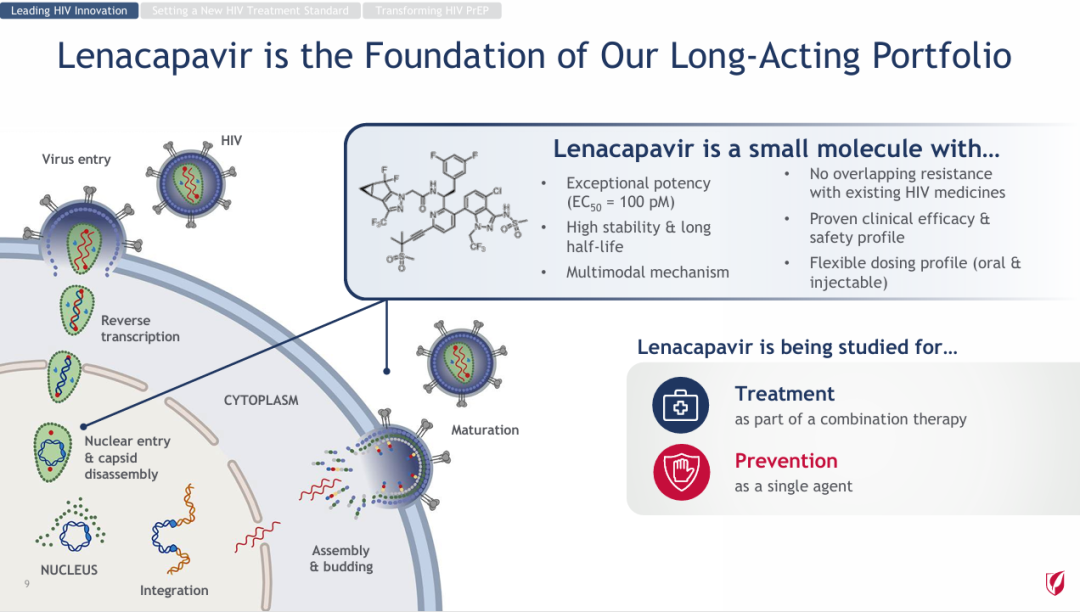
NO.8 lenacapavir PURPOSE 1研究
公司:吉利德
里程碑意义:离终结艾滋病流行又进一步
6月20日,吉利德公布了一项关键III期PURPOSE 1试验的中期分析结果,表明该公司每年仅需注射两次的HIV-1衣壳抑制剂lenacapavir在暴露前预防(PrEP)女性HIV感染的有效率达100%。
Lenacapavir是一款first-in-class长效HIV衣壳抑制剂,可通过干扰病毒生命周期的多个重要步骤抑制HIV-1的复制,包括抑制由病毒衣壳介导的HIV-1前病毒DNA的摄取、组装和释放,以及病毒衣壳核心的形成,而且对其他现有药物类型没有已知的交叉耐药性。2022年,该药物已获FDA批准上市,用于治疗HIV-1感染。
PURPOSE 1研究达到了关键疗效终点,即每半年注射1次lenacapavir的预防效果优于一日一次的Truvada(恩曲他滨200mg和富马酸替诺福韦二吡酯300mg)和HIV背景发病率。
在lenacapavir组的2134名妇女中,有0例HIV感染事件(发病率为0.00/100人-年)。在Truvada组的1068名妇女中有16例事件(发病率1.69/100人-年)。
这是吉利德里程碑式的PURPOSE项目产生的第一批数据。PURPOSE项目包括世界各地的5项艾滋病毒预防试验,是迄今为止开展的最全面、最多样化的艾滋病毒预防试验项目。
该项目的另一项关键试验PURPOSE 2已于今年9月获得结果,该试验旨在评估lenacapavir在全球男性、变性男性、变性女性等不同性别个体中的PrEP效果。
与背景HIV发病率相比,lenacapavir将HIV感染率降低了96%。在lenacapavir组的2180名参与者中,有2例感染病例,相当于99.9%的参与者没有感染HIV;lenacapavir治疗效果也优于Truvada治疗。
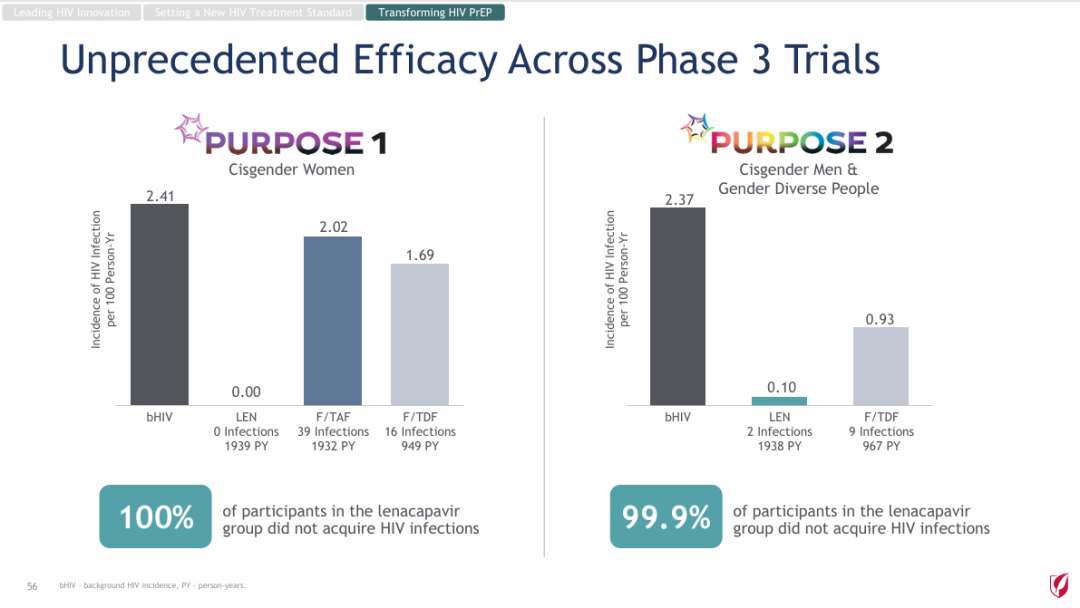
Lenacapavir在这两项III期研究中取得的显著成果,证明了它有可能改变艾滋病的预防方式,并帮助终结艾滋病的流行。基于此,吉利德曾表示,会在今年底前开始该药物用于PrEP的一系列全球监管申报工作。
如果获得批准,lenacapavir可以为艾滋病预防提供一个关键的新选择,可以推动艾滋病流行率进一步下降,终结艾滋病流行变得不再遥不可及。虽然传统的艾滋病预防方案在按规定服用时非常有效,但该药物可以帮助解决一些人在服用口服PrEP药片时可能面临的歧视,并有助于提升患者用药的依从性和持久性。
NO.9 nerandomilast FIBRONEER-IPF研究
公司:勃林格殷格翰
里程碑意义:十年来首个达到主要终点的III期IPF研究
9月16日,勃林格殷格翰宣布,其潜在首创PDE4B抑制剂nerandomilast治疗特发性肺纤维化(IPF)的III期FIBRONEER-IPF研究达到其主要终点,即与安慰剂相比,第52周时患者的用力肺活量(FVC,衡量肺功能的指标)较基线的绝对变化。十年来,这是第一个达到主要终点的III期IPF试验。
FIBRONEER-IPF研究在全球30多个国家开展,入组1177例患者,这也是IPF领域最大规模的临床试验。基于该研究结果,勃林格殷格翰计划向FDA及全球范围内的其他监管机构递交nerandomilast用于治疗IPF的新药申请,有望进一步满足该疾病领域的迫切需求。
特发性肺纤维化(IPF)是一类最常见的进展性纤维化间质性肺疾病,其临床症状包括:活动诱发的呼吸急促、持续干咳和胸部不适等。尽管被视为“罕见”病,但IPF影响了全球约三百万人。此类疾病预后较差,确诊后中位生存期仅3-5年。
然而,临床上治疗手段却有限。根据医药魔方数据库,全球范围内目前仅吡非尼酮和尼达尼布两款创新药被批准用于治疗IPF,而尼达尼布的开发者正是勃林格殷格翰。

NO.10 sotatercept ZENITH研究
公司:默沙东
里程碑意义:首个因压倒性疗效提前结束的PAH研究
11月25日,默沙东宣布,其首创ACVR2A-Fc融合蛋白sotatercept(Winrevair)治疗肺动脉高压(PAH)功能分级III级或IV级高死亡风险成人的III期ZENITH研究达到了其主要终点,即首次发病或死亡事件(全因死亡、肺移植或与PAH恶化相关的住院时间≥24小时)发生的时间。
在ZENITH研究中,与安慰剂相比,sotatercept在统计学上显著降低了发病或死亡事件的风险,并具有临床意义,这两种治疗都是在PAH背景治疗的基础上进行的。
基于这些结果的优势,独立数据监测委员会建议提前停止ZENITH研究,并通过SOTERIA开放标签扩展研究为所有参与者提供接受sotatercept治疗的机会。这是PAH领域第一项在中期分析展现压倒性疗效而提前结束的研究。
PAH是一种严重的进展性疾病,发病率和死亡率都很高,其临床表现为肺部小动脉增生性重塑和管腔逐渐狭窄。据估计,2021年全球约4000万例PAH患者,5年死亡率约为43%。目前,市场上现有的PAH疗法可通过促进肺血管扩张来缓解患者病情,但无法从根本上解决肺血管重塑的问题。

研究表明,转化生长因子β(TGF-β)超家族成员介导的细胞增殖和抗凋亡信号通路失衡是驱动PAH患者肺血管重塑的重要机制之一。激活素2A型受体(ACVR2A)便是TGF-β超家族的成员之一。因此,靶向ACVR2A的药物是逆转肺血管重塑的潜在有效途径。
Sotatercept是一种首创ACVR2A-Fc融合蛋白 ,由人Activin受体IIA的胞外结构域与IgG1的Fc结构域融合而成,可以结合和捕获TGF-β家族配体。2021年9月,默沙东以115亿美元的价格收购Acceleron Pharma,囊获sotatercept。
今年3月,基于III期STELLAR研究的结果,sotatercept在美国获批上市。自上市之后,sotatercept强劲增长,差不多半年时间其全球销售额便达1.49亿美元。从快速的放量增长中,也能反映出sotatercept针对PAH治疗的临床变革意义。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


