上海科技大学发表最新Cell论文
来源:生物世界 2025-07-13 09:31
该研究解析了麻疹病毒(MeV)聚合酶复合物及其与非核苷抑制剂结合后的结构,并揭示了抑制机制,为抗病毒药物的理性设计奠定了基础。
2025 年 7 月 7 日,上海科技大学张贺桥/Roger Kornberg 团队在国际顶尖学术期刊 Cell 上发表了题为:Structures of the measles virus polymerase complex with non-nucleoside inhibitors and mechanism of inhibition 的研究论文。
该研究解析了麻疹病毒(MeV)聚合酶复合物及其与非核苷抑制剂结合后的结构,并揭示了抑制机制,为抗病毒药物的理性设计奠定了基础。

在这项最新研究中,研究团队确定了麻疹病毒聚合酶复合物 apo 状态下以及与两种非核苷抑制剂 ERDRP-0519 和 AS-136A 结合时的冷冻电镜结构,分辨率分别为 3.0 Å、3.4 Å 和 3.3 Å。
结果显示,抑制剂结合会引发麻疹病毒聚合酶复合物的催化环的构象变化,通过变构作用将聚合酶锁定在一种无活性的“GDN-out”状态。这一发现促使研究团队提出,ERDRP-0519 对尼帕病毒(NiV)也可能有效,尼帕病毒同样属于副粘病毒科,是一种高致病性的病毒,其感染可导致人类严重的神经和呼吸系统疾病,近期死亡率高达 70%,且目前尚无针对尼帕病毒的抗病毒药物获得批准。
研究团队进一步通过尼帕病毒聚合酶复合物的结构测定以及转录抑制作用证实了这一推测。
该研究的核心发现:
-
解析了麻疹病毒(MeV)聚合酶复合物在 apo 状态和结合抑制剂状态下的结构;
-
非核苷类抑制剂与聚合酶的催化环附近结合;
-
非核苷类抑制剂通过变构作用抑制聚合酶活性;
-
ERDRP-0519 能同时抑制麻疹病毒和尼帕病毒的聚合酶。
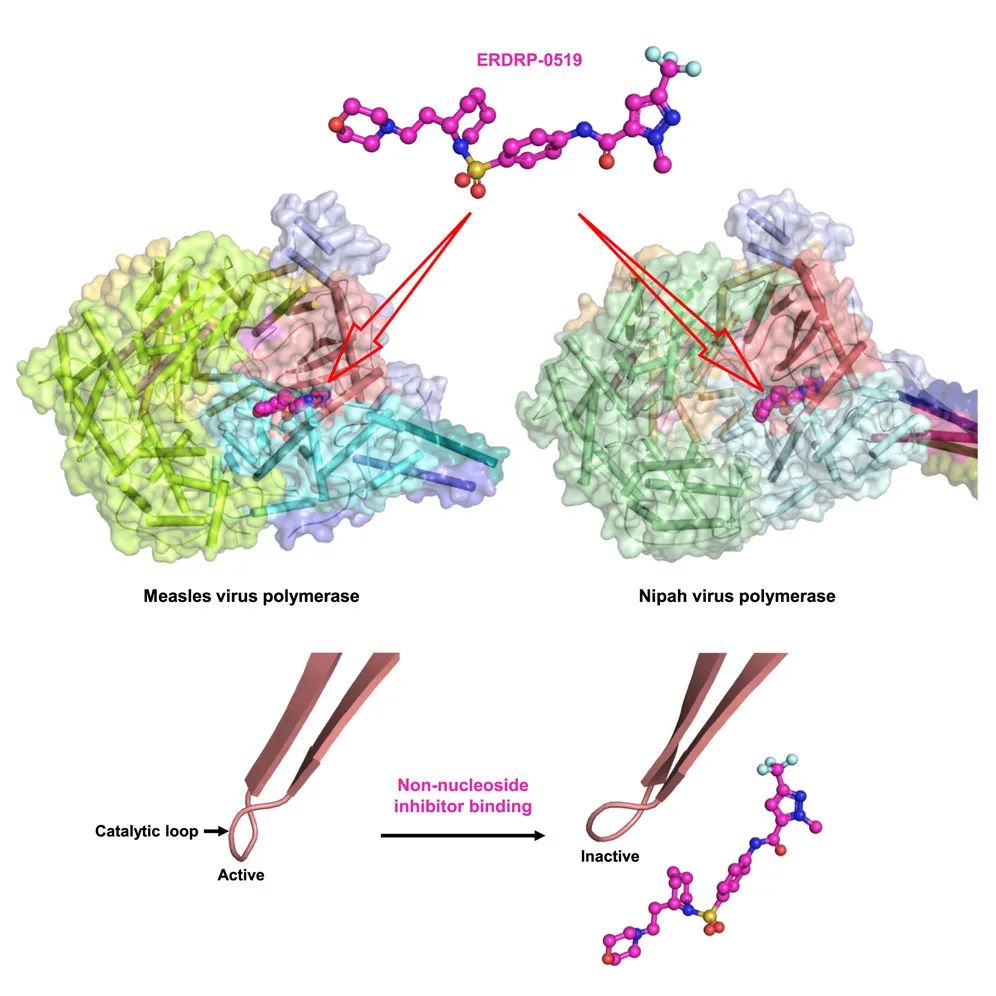
这项研究为针对麻疹病毒和尼帕病毒的这两种尚无药可用的病毒的抗病毒药物理性设计奠定了基础。值得注意的是,ERDRP-0519 之前已被证明具有口服生物利用度,且在临床前模型中显示出体内疗效,可作为进一步开发为抗病毒药物的有希望的候选药物。
论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(25)00683-X
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


