《科学·进展》:STK11突变的肺癌,有救了!
来源:奇点糕 2023-04-25 07:49
本次研究的发现表明,在NSCLC基因工程小鼠模型中,同时使用MEK抑制剂曲美替尼和HDAC3抑制剂entinostat可以有效抑制肿瘤进展。先前已有诸多研究表明,在黑色素瘤和胰腺癌患者中,HDAC抑制
靶向治疗凭借着“肿瘤细胞针对性强+低副作用”的特点,已逐渐成为目前癌症治疗领域冉冉升起的一颗新星[1]。然而,靶向治疗并非对所有肿瘤都有奇效,例如具有LKB1基因突变(又称STK11突变)的非小细胞肺癌(NSCLC)。
NSCLC是最常见的肺癌类型,其中约有20%-30%的患者带有LKB1突变,这部分患者对标准化疗与免疫+化疗方案的应答均不理想,既往也没有直接针对LKB1突变的酪氨酸激酶抑制剂(TKIs)类靶向药物。
传统TKIs做不到的事,不代表表观遗传类靶向药做不到,例如组蛋白去乙酰化酶(HDAC)抑制剂,目前已有多种HDAC抑制剂被美国FDA批准,用于治疗血液系统恶性肿瘤[2-3]。那么HDAC抑制剂是否可以用于LKB1突变型NSCLC的治疗呢?
近日,由索尔克研究所教授Reuben Shaw和前博士后Lillian Eichner(现为美国西北大学助理教授)领导的研究团队在Science Advances期刊发表了最新研究成果[4]。研究发现,HDAC家族中的HDAC3是LKB1突变型NSCLC生长所必需的,先前未被发现的HDAC3靶基因——FGFR1,还介导了此类肿瘤对MEK抑制剂曲美替尼的耐药。
基于上述发现,Reuben等人提出了针对LKB1突变型NSCLC的靶向联合治疗新策略:HDAC3抑制剂entinostat联合MEK抑制剂曲美替尼,二者联合用药在动物实验中有效抑制了NSCLC的肿瘤进展。

论文首页截图
尽管HDAC3抑制剂作为治疗药物取得了很大的临床进展,但HDAC3在肿瘤发生中的潜在作用在很大程度上仍然是未知的,因为之前的许多研究都着眼于其在代谢组织中的功能和作用机制。
鉴于此,Reuben等人首先利用KRAS突变基因工程小鼠模型探索了HDAC3在NSCLC肿瘤发生中的作用。研究者们发现,不论是在KRAS突变合并LKB1缺失(KL),还是KRAS突变合并p53缺失(KP)的NSCLC小鼠中,与同窝对照组相比,HDAC3敲除小鼠的肿瘤生长在早期和晚期均明显被抑制,其肿瘤数量明显减少,肿瘤大小明显减小。
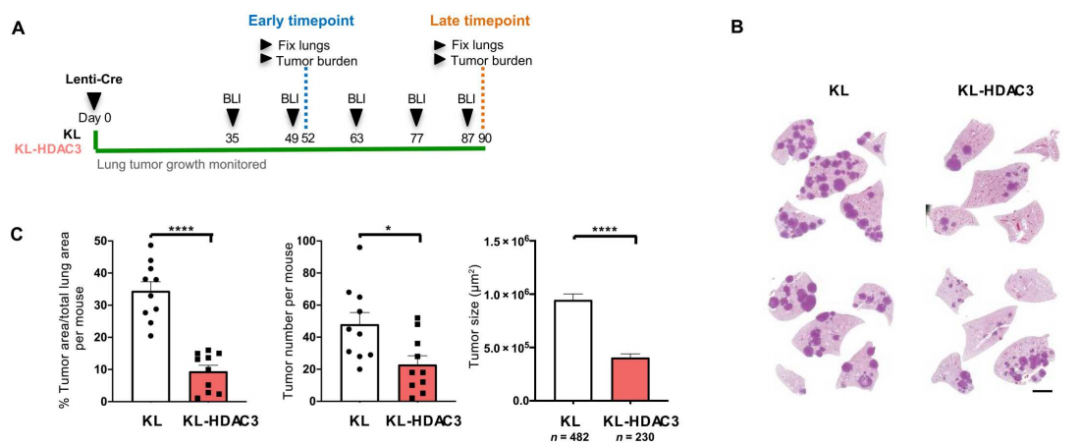
HDAC3对NSCLC的发生至关重要
因此,研究人员得出初步结论,HDAC3对KL和KP基因型驱动的NSCLC肿瘤生长至关重要,那么这种作用是通过怎样的分子机制实现呢?
为了回答这一问题,研究人员对KL和KP原发NSCLC肿瘤细胞进行了HDAC3的ChIP-seq测序,以识别全基因组内源性结合的HDAC3靶位点。结果显示,在KL和KP肿瘤中,共有1522个峰被HDAC3结合,对应于753个非冗余基因,其中富集程度最高的是转录因子NK2同源盒子1(NKX2-1)。
接下来研究人员评估了HDAC3和NKX2-1是否在NSCLC细胞中协调控制一组共同的靶基因,数据显示,在来源于KL原发性NSCLC肿瘤的永生化细胞系LJE1细胞中,HDAC3-KO和NKX2-1-KO以相同的方向影响基因表达变化。
RNA-seq结果表明,在NKX2-1-KO调控的基因中,83%也受到HDAC3-KO的调控,这表明大多数依赖NKX2-1的基因几乎都受到HDAC3的调控。
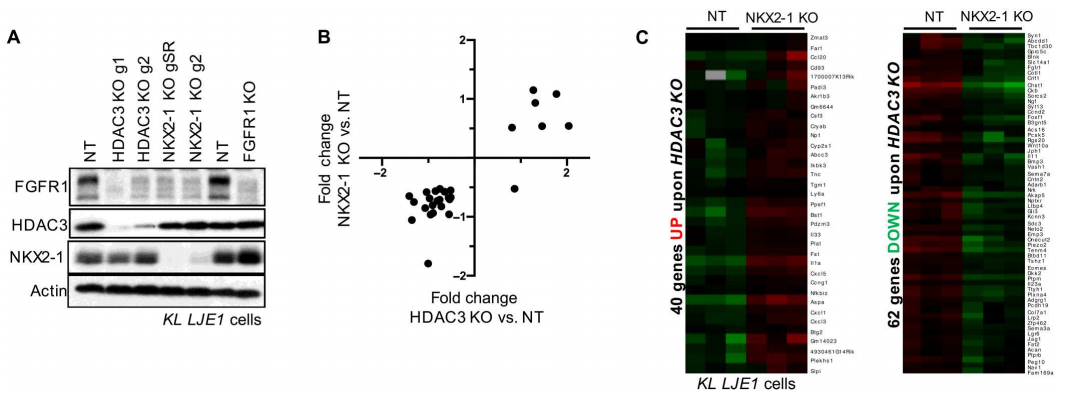
HDAC3与NKX2-1调控一组共同的靶基因的表达
在HDAC3和NKX2-1共同调控的靶基因中,Reuben等人选择了成纤维细胞生长因子受体1(FGFR1)进行进一步验证,它是组成FGFR蛋白家族的四种受体酪氨酸激酶之一,广泛参与促进肿瘤生长[5]。
RNA-seq分析结果表明,FGFR1的mRNA水平在NKX2-1-KO和HDAC3-KO的NSCLC细胞系中均下调;此外HDAC3和NKX2-1敲除,也显著下调了NSCLC细胞中FGFR1蛋白的表达水平。
值得注意的是,FGFR1已被证明介导了肿瘤患者对MEK抑制剂曲美替尼耐药的产生,MEK抑制剂是FDA批准的适用于包括NSCLC在内的多种肿瘤的临床用药,但是肿瘤患者极易对其产生耐药,其单药缓解率仅为12-30%,因此MEK抑制剂在临床中往往和其它靶向药物,如BRAF抑制剂联合使用 [6]。
既然在NSCLC中,HDAC3是FGFR1蛋白表达所必需的,那么使用HDAC3抑制剂,能否克服肺癌患者对曲美替尼的耐药呢?
为了验证这一点,研究人员首先在体外用曲美替尼对NSCLC细胞系进行了处理,可以看到,在长期曲美替尼处理后,NSCLC细胞表现出明显的耐药性,其FGFR1蛋白水平显著提高,但曲美替尼联合HDAC3抑制剂entinostat则可以逆转这一现象,也就是说,HDAC3抑制剂可以克服肺癌细胞对曲美替尼治疗的耐药。
接下来,研究者评估了上述HDAC3抑制剂entinostat联合MEK抑制剂曲美替尼,在LKB1突变型NSCLC小鼠模型体内的疗效:相比于曲美替尼单独治疗组,entinostat联合曲美替尼治疗组处理的小鼠表现出更低的肿瘤负荷,其肺部肿瘤体积减少79%,肿瘤数量减少63%。
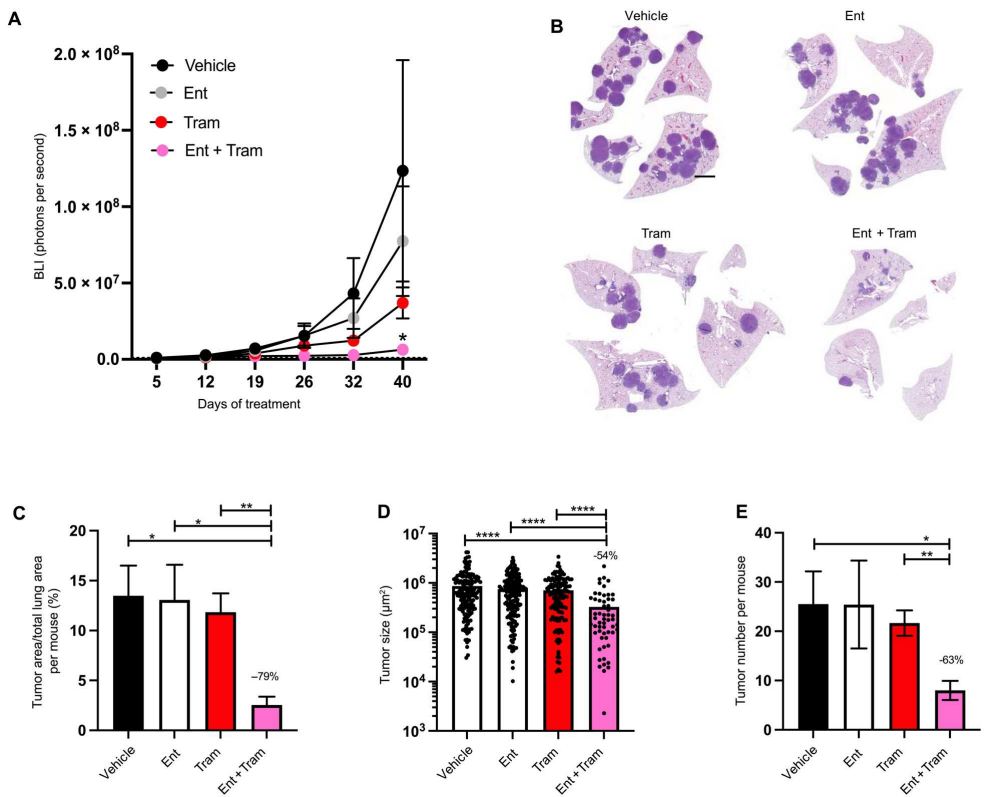
曲美替尼联合entinostat可有效抑制NSCLC的发展
H&E染色切片中定量的肿瘤负荷也显示出类似的结果,与对照组相比,单独使用曲美替尼或entinostat都不会减轻肿瘤负荷,但二者的联合用药则可显著降低肿瘤负荷。
总之,本次研究的发现表明,在NSCLC基因工程小鼠模型中,同时使用MEK抑制剂曲美替尼和HDAC3抑制剂entinostat可以有效抑制肿瘤进展。先前已有诸多研究表明,在黑色素瘤和胰腺癌患者中,HDAC抑制剂可有效克服曲美替尼耐药的产生,而HDAC3正是克服曲美替尼耐药的关键靶点[7]。
而此次Reuben等人将上述联合用药方案在NSCLC治疗中的可行性进行了验证,并阐明了其具体机制,提出了一项有效的针对LKB1突变型NSCLC的靶向联合治疗新策略。论文第一作者兼共同通讯作者Lillian Eichner博士表示,这项研究证明HDAC3对于LKB1突变型NSCLC是不可或缺的,将有望成为治疗新靶点,后续将基于研究结论尽快开展临床研究。
参考文献:
[1]肖天龄,李娜,王娅丹等.靶向治疗在卵巢癌中的研究进展[J].癌症进展,2022,20(14):1428-1433.
[2] A. C. West, R. W. Johnstone, New and emerging HDAC inhibitors for cancer treatment.J. Clin. Invest. 124, 30–39 (2014).
[3] E. Ceccacci, S. Minucci, Inhibition of histone deacetylases in cancer therapy: Lessons from leukaemia. Br. J. Cancer 114, 605–611 (2016).
[4] Eichner LJ, Curtis SD, Brun SN, et al. HDAC3 is critical in tumor development and therapeutic resistance in Kras-mutant non-small cell lung cancer. Sci Adv. 2023.
[5] S. Dai, Z. Zhou, Z. Chen, G. Xu, Y. Chen, Fibroblast growth factor receptors (FGFRs):Structures and small molecule inhibitors. Cell 8, 614 (2019).
[6] E. Manchado, S. Weissmueller, J. P. Morris, C. C. Chen, R. Wullenkord, A. Lujambio, E. de Stanchina, J. T. Poirier, J. F. Gainor, R. B. Corcoran, J. A. Engelman, C. M. Rudin, N. Rosen,S. W. Lowe, A combinatorial strategy for treating KRAS-mutant lung cancer. Nature 534,647–651 (2016).
[7] Z. Wang, S. Hausmann, R. Lyu, T.-M. Li, S. M. Lofgren, N. M. Flores, M. E. Fuentes,M. Caporicci, Z. Yang, M. J. Meiners, M. A. Cheek, S. A. Howard, L. Zhang, J. E. Elias, M. P. Kim,A. Maitra, H. Wang, M. C. Bassik, M.-C. Keogh, J. Sage, O. Gozani, P. K. Mazur, SETD5-coordinated chromatin reprogramming regulates adaptive resistance to targeted pancreaticcancer therapy. Cancer Cell 37, 834–849.e13 (2020).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


