3月Nature杂志重磅级亮点研究解读!
来源:生物谷原创 2025-03-26 09:49
时光总是匆匆易逝,转眼间3月份即将结束,在即将过去的3月里,Nature杂志又有哪些亮点研究值得一读呢?小编对相关亮点文章进行了整理,分享给大家!
【1】Nature:科学家揭开基因“功能组”奥秘,利用在线资源描述了2万多个人类基因的功能
doi:10.1038/s41586-025-08592-0
基因本体联盟(Gene Ontology Consortium)是一种全面的百科全书,其涵盖了所有蛋白质编码人类基因的已知功能,如今来自该联盟的一个新的资源已经完成且在一个新的网站上进行了发布。近日,一篇发表在国际杂志Nature上题为“A compendium of human gene functions derived from evolutionary modeling”的研究报告中,来自南加利福尼亚大学等机构的科学家们通过研究首次利用大规模进化模型成功将人类基因数据与收集自其它生物体的遗传数据进行了整合并分析。这最终就会形成一种可搜索的公共资源,该资源库利用最准确和完整的证据列出了2万多个基因的已知功能。
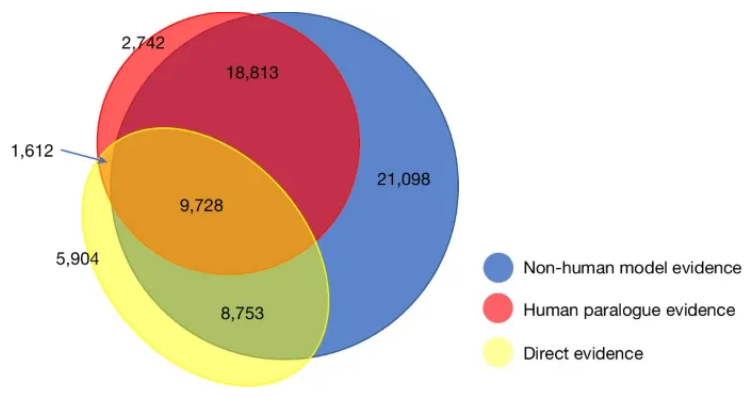
PAN-GO注释的实验证据来源
作为一个不断扩大并完善超过25年的一个知识库,基因本体(Gene Ontology,是一个在生物信息学领域中广泛使用的本体)如今已经成为了生物医学研究过程的支柱,每年都有超过3万份出版物使用其来辅助数据分析和解释。从事“组学”实验(对DNA、RNA、蛋白和其它生物分子进行大规模研究)的生物医学研究人员所产生的数据就能识别出数百个感兴趣的基因,比如,研究人员可能会学习相比健康细胞而言,癌症细胞中哪些基因会被开启或关闭。
回顾数千篇关于每个基因已知功能的已经发表的文章是不可能的,因此很多科学家们转向求助于基因本体,研究者Paul D. Thomas博士说道,我们的知识库就能促使科学家们通过仅仅一个基因列表就能理解其生物学功能,包括可能对开发疗法有用的基因。如今这一最新的里程碑在知识库中能提供一种新的资源,并利用进化模型来使这一工具更加强大;这种方法就能允许研究人员将收集自人类基因的实验数据与模式生物(比如小鼠和斑马鱼)中相关基因中获得的数据相结合,并能提供一张关于人类基因功能更完整的图片,包括填补科学知识的空白,而通过对来自人类研究的直接证据或许是不可用的。
【2】Nature:一把双刃剑!染色体的关键区域或能以超高速进化赋予人类一个更好的大脑,但同时也会导致大脑疾病风险增加
doi:10.1038/s41586-025-08622-x
人类加速进化区(HARs,human accelerated regions)是一种保守的基因组位点,在人类与黑猩猩分化后经历了快速的核苷酸替换,HARs富集于机体神经发育基因附近的候选调节性区域中,这就揭示了其在基因调节中的关键作用,然而,其靶基因和对人类大脑发育的功能性贡献在很大程度上是未知的。人类的大脑如何进出能使用复杂语言、文明等等方面技能,答案或许在于特殊的DNA。
近日,一篇发表在国际杂志Nature上题为“Comparative characterization of human accelerated regions in neurons”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,我们机体中的部分染色体或能以惊人的速度让我们在大脑发育方面要比猿类更有优势,但这或许也会让人类面临独特的大脑疾病风险。
文章中,研究人员重点关注了称之为人类加速进化区(HARs)的染色体部分,自从人类在进化树上与黑猩猩分离以来,这些染色体区域就进化地最快,且其要比哺乳动物的预期进化速率快10倍。研究人员分析了来自人类的人工神经元和黑猩猩细胞系中的HARs所产生的影响。
研究者表示,人类和黑猩猩的基因组有99%的相似性,而HARs仅占到了1%差异中的很大一部分,这或许就会导致在培养皿中人类和黑猩猩神经元所产生的结果截然不同。人类神经元能生长出多个神经突(neurites),这些神经突是能帮助神经细胞发送和接收信号的丝状突起;但是黑猩猩机体的神经元仅能生长出单一的神经突,当将人类机体的HARs工程化修饰植入到黑猩猩的人工神经元中时,黑猩猩的神经元就能生长出较多神经突结构。
【3】Nature:科学家发现人类罕见疾病此前未被识别的遗传决定因素
doi:10.1038/s41586-025-08623-w
有高达80%的罕见病患者在基因组测序分析后仍然未得到疾病诊断,其中很多可能涉及尚未发现的疾病-基因关联的致病性突变。近日,一篇发表在国际杂志Nature上题为“Rare disease gene association discovery in the 100,000 Genomes Project”的研究报告中,来自伦敦大学玛丽皇后学院等机构的科学家们通过研究发现了69种此前并未被识别的罕见疾病的遗传决定因素,包括罕见的癫痫症和精神分裂症等。
文章中,研究人员利用一种新型分析方法识别出了罕见疾病的遗传基础,这或许能帮助诊断更多的罕见病病例并帮助开发针对性的新型疗法。目前罕见病在全球范围内共影响着4%至6%的人群健康,尽管科学家们在遗传测试上取得了一定的进步,但由于缺乏可能导致疾病的遗传突变的整局,从而就导致了高达80%的罕见病患者即使进行了基因组测序分析,依然未得到疾病诊断。
为了解决这一问题,这项研究中,研究人员开发了一种特殊的分析框架,其能通过罕见的突变基因负担分析来识别出孟德尔疾病(Mendelian diseases)的遗传原因,该病是由单一基因突变所引起的机体遗传性障碍。研究人员所开发的新方法相比对照组而言,能发现患有特殊遗传性障碍的患者群体机体中常见的遗传变化。
【4】Nature:打破常规!宿主机体的免疫细胞或会将细菌转化成为赖以生存的关键营养物质!
doi:10.1038/s41586-025-08629-4
巨噬细胞能专门发挥吞噬作用,这是一种通过内化和降解消除包括微生物在内的细胞外物质的特殊细胞过程,尽管吞噬作用在细菌感染过程中发挥着关键作用,但被吞噬的微生物“货物”的命运以及其宿主细胞所产生的影响,目前研究人员知之甚少。
近日,一篇发表在国际杂志Nature上题为“Macrophages recycle phagocytosed bacteria to fuel immunometabolic responses”的研究报告中,来自法国波尔多大学等机构的科学家们通过研究发现,“吃掉”体内细菌的免疫细胞并不会向以前认为的那样将细菌专门藏在一个小区室中,而是会将其转化为制造蛋白质、产生能量并维持细胞活性的关键营养物质。

被杀死细菌的吞噬作用或能为巨噬细胞的线粒体呼吸链提供燃料
研究者Angelo D'Alessandro说道,人如其食(We are what we eat),我们所吃的东西会改变我们机体的组成,当免疫细胞吃掉细菌时也会发生相同的事情;当巨噬细胞吃掉细菌时就会在机体中诱发免疫反应,但当他们吃掉死细菌时或许就不会了。当吞噬细胞吃掉死细菌时,其循环利用的一部分小分子就会告诉它们不要引起机体炎症,一切都会好起来的;而当吞噬细胞摄入活细菌时,这种“劝导”信号就不会存在,同时也会引起驱动很多疾病的机体炎症。
doi:10.1038/s41586-025-08633-8
脑癌所引起的肿胀(swelling)是一种会导致机体严重副作用甚至死亡的严重问题,尽管控制肿胀非常重要,但近日,一篇发表在国际杂志Nature上题为“Programs, origins and immunomodulatory functions of myeloid cells in glioma”的研究报告中,来自凯斯西储大学医学院等机构的科学家们通过研究发现,一种常用的抗肿胀药物在服用后或会抑制机体免疫系统数周,从而抑制机体抵御癌症的能力。
文章中,研究人员观察并分析了来自脑癌患者机体的骨髓细胞(myeloid cells),这些细胞组成了大脑肿瘤的很大一部分,而且也已经被证明在免疫抑制过程中扮演着关键角色。研究人员利用单细胞和空间转录组学技术分析了来自100多份脑瘤样本中的骨髓细胞,旨在分析其如何影响机体抵御癌症的免疫反应。单细胞转录组学研究揭示了RNA在细胞中表达的方式并暗示其了功能,而空间转录组学技术则揭示了这些细胞在组织中的定位情况。
研究人员在脑癌中发现了一种一致性的细胞组织,而且每种类型的骨髓细胞都能在特定区域中被发现且适应期作用。值得注意的是,研究人员在肿瘤中发现了两类免疫抑制性的骨髓细胞,一种与死亡组织的区域有关,另一种则与抗肿胀疗法有关;在接受地塞米松治疗的患者中,这些细胞所产生的免疫抑制效应要明显高于未接受地塞米松治疗的患者,而且随着药物剂量的增加,这种影响作用会更强。
【6】Nature:科学家揭示了一种神秘HIV病毒组分的重要功能
doi:10.1038/s41586-025-08624-9
HIV-1(人类免疫缺陷病毒I型)的病毒颗粒能以一种未成熟、非传染性的形式释放,其主要结构多聚蛋白Gag进入功能结构域的蛋白水解切割作用能诱导其重排成为成熟具有传染性的病毒粒子;在未成熟的病毒颗粒中,Gag膜结合结构域MA能形成一种六聚体蛋白质晶格,其在裂解后会经历结构转变成为一种独特的成熟MA晶格结构,目前研究人员并不清楚MA晶格成熟背后的分子机制。
近日,一篇发表在国际杂志Nature上题为“The conserved HIV-1 spacer peptide 2 triggers matrix lattice maturation”的研究报告中,来自德国马普生化研究所等机构的科学家们通过研究发现了HIV生命周期中的一个重要步骤发生背后的分子机制,他们通过联合研究后指出,名为“间隔肽2”(SP2,spacer peptide 2)的神秘病毒组分在将未成熟HIV-1颗粒转化成为感染性颗粒的过程中发挥着关键作用。
HIV-1颗粒能以一种未成熟的非传染性形式从感染细胞中释放出来,病毒颗粒的主要构建原料是一种称之为Gag的大约2000个拷贝的长棒状蛋白质,为了变得具有传染性,HIV就必须经历成熟过程,这主要涉及HIV-1蛋白酶(一种病毒酶类),其能将Gag切割成为六种更小的蛋白质,包括衣壳蛋白和基质蛋白,从而就会引起病毒组分发生巨大的结构重排。多年以来,科学家们一直在探索包裹着基因组的病毒衣壳的结构变化,相比而言,他们对病毒的基质了解的就要少很多,病毒基质是包裹病毒的脂质膜下的特殊外膜蛋白,如今研究人员阐明了这种基质蛋白在成熟成为感染性颗粒的过程中是如何进行重新排列的。
【7】Nature:大脑中的“决策司令部”,科学家发现大脑中控制行为选择的关键区域
doi:10.1038/s41586-025-08672-1
在生活的十字路口,我们常常面临选择:是坚持眼前的路,还是去探索新的方向?这种“坚持与探索”的决策不仅影响着我们的生活,也是动物在自然环境中为了生存必须掌握的技能。从觅食的鸟儿到在复杂环境中穿梭的猴子,它们如何在熟悉与未知之间灵活切换,一直是科学家们研究的难题。
近日,一篇发表在国际杂志Nature上题为“A subcortical switchboard for perseverative, exploratory and disengaged states”的研究报告中,来自英国伦敦大学学院等机构的科学家们通过研究揭开了大脑中一个神秘的“行为切换中枢”—中缝核(MRN,median raphe nucleus),其或许是动物行为策略的关键调控者。

表达VGTA的MRN神经元能控制机体的持续性状态
近年来,科学家们一直在探索大脑是如何在坚持、探索和放弃之间灵活切换的,这些行为模式对动物的生存至关重要,但背后的神经机制一直是个谜;这项研究中,研究人员发现的中缝核或许就是调节这些行为策略的核心区域。为了探索这一问题,研究人员选择了小鼠作为实验对象,他们对这些小鼠进行基因改造使其能表达光敏感蛋白,从而就能通过光刺激精确操控特定神经元的活动。实验的核心是一个充满新奇物体的盒子,研究者将小鼠置于其中,并利用摄像头记录其行为,随后通过机器学习算法进行分析。
【8】Nature:科学家有望开发出阿片类药物替代化合物,既能缓解机体疼痛又不会产生额外副作用
doi:10.1038/s41586-025-08618-7
如今慢性疼痛的治疗依然高度依赖于阿片类药物,尽管这种药物非常有效,但却很容易让患者上瘾,如果滥用的话甚至会产生致命性风险。近日,一篇发表在国际杂志Nature上题为“A cryptic pocket in CB1 drives peripheral and functional selectivity”的研究报告中,来自华盛顿大学医学院等机构的科学家们在寻找一种安全有效的阿片类药物替代物的过程中成功开发了一种化合物,其能模仿大麻植物中发现的一种天然分子,并利用其疼痛缓解的特性,且不会对小鼠造成成瘾或改变思维等副作用。
尽管后期还需要进行更多研究,但这种化合物有望作为一种非成瘾止痛剂,来帮助美国遭受慢性疼痛折磨的5000万患者。研究者Susruta Majumdar博士表示,目前我们迫切需要开发针对慢性疼痛的非成瘾疗法,而这也是我们实验室过去15年里研究的重点工作;这项研究中,我们所制造的定制设计化合物能附着到机体的镇痛受体(pain-reducing receptors)上,按照设计要求,其不能到达大脑中,这就意味着这种化合物能避免诸如情绪改变等精神活性副作用,而且不会让个体上瘾,因为其不会作用于机体大脑中的奖惩中心。
阿片类药物能减弱大脑中的疼痛感觉,并会劫持大脑的奖惩系统,从而诱发多巴胺的释放及愉悦感觉,这就会让个体对药物容易上瘾;尽管广泛的公共卫生机构警告和媒体关注阿片类药物成瘾的危害,但其仍然会引发大量使用者因过量摄入而死亡。2022年,美国大约有8.2万死亡案例与阿片类药物摄入有关,这就是为何科学家们希望努力研究开发疼痛替代疗法的原因了。几千年来,人们已经将大麻当做一种疼痛疗法,而且临床试验也评估了是否大麻能长期缓解机体疼痛,但不可避免的是,大麻所产生的精神活性副作用一直都是个大问题,从而就使其无法被视为治疗疼痛的可行选择,然而如今研究人员就能克服这一问题。
【9】阿司匹林竟能抗癌?!Nature:科学家揭示阿司匹林通过刺激免疫系统减少癌症转移的分子机制
doi:10.1038/s41586-025-08626-7
癌症转移(metastasis)是癌细胞从原发肿瘤扩散到身体其他部位的过程,它是90%癌症相关死亡的主要原因。然而,科学家们最近发现,一种常见的药物——阿司匹林,可能成为阻止癌症转移的“秘密武器”。近日,一项发表在《Nature》上的研究揭示了阿司匹林通过刺激免疫系统减少癌症转移的分子机制。这项由剑桥大学等机构的科学家们主导的研究,不仅为阿司匹林的抗癌潜力提供了科学依据,还为开发更有效的抗癌药物奠定了基础。

ARHGEF1会抑制T细胞对癌症转移的免疫力
阿司匹林是一种广为人知的药物,常用于缓解疼痛、退烧和预防心脏病发作。然而,近年来,科学家们发现它可能还有另一个重要角色:抗癌战士。此前的研究表明,每日服用低剂量阿司匹林可以减少某些癌症(如乳腺癌、结直肠癌和前列腺癌)的转移风险。但直到现在,阿司匹林如何实现这一效果的具体机制仍是个谜。
在这项最新研究中,科学家们发现,阿司匹林通过抑制一种名为血栓素A2(TXA2)的凝血因子,解除了对T细胞的抑制,从而增强了免疫系统对转移癌细胞的攻击能力。T细胞是免疫系统中的“杀手”,负责识别并消灭癌细胞。然而,在癌症转移过程中,TXA2会抑制T细胞的功能,使癌细胞得以逃脱免疫系统的追捕。阿司匹林通过减少TXA2的产生,恢复了T细胞的活性,从而阻止了癌症的扩散。
【10】Nature:重要发现!不同物种造血干细胞的差异或为阐明衰老机制提供了新的见解!
doi:10.1038/s41586-025-08625-8
造血干细胞在机体一生中会维持血液的生成。尽管科学家们已经对实验室小鼠进行了广泛的研究,但对小鼠衰老过程中机体造血干细胞库的克隆选择和群体动态仍知之甚少。近日,一篇发表在国际杂志Nature上题为“Clonal dynamics and somatic evolution of haematopoiesis in mouse”的研究报告中,来自贝勒医学院等机构的科学家们通过研究表明,不同物种间的造血干细胞差异或能揭示对衰老的新见解。
研究者表示,人类和小鼠血液干细胞在其一生中的演变方式存在巨大差异,这些发现或为理解影响组织衰老的关键因素提供了新的认识;人类在老年事血液中出现的剧烈变化在老年小鼠中并未出现。这一研究或提出了关于衰老和实验室中使用的干细胞研究模型的重要问题,并为理解促进组织衰老的因素提供了更全面深入的理解;所有细胞在一生中都会积累称之为体细胞突变的遗传变化,在人类机体中,这些体细胞突变会导致个体在70岁以后机体血液发生剧烈变化。
年轻人机体中有高达20万个干细胞用于血液生成,而在老年人机体中,超过一半的血液产生来自于数量大幅减少的干细胞克隆群,这些克隆会在个体一生中不断扩张,而且在老年机体中这些干细胞克隆可能会发展为癌症并引发其它疾病。有一种理论认为,其甚至可能构成人类衰老的特征,这就解释了解释为何机体的组织会随着年龄增长而变得不那么具有复原力。目前研究人员并不清楚在人类中观察到的现象是否是衰老表现的普遍模式,以及是否其会在其它物种(包括寿命较短的动物,如小鼠等)的衰老过程中出现类似的模式。
【11】减肥界的“新星”!Nature:科学家识别出一种能抑制机体食欲并促进减肥的新型分子!
doi:10.1038/s41586-025-08683-y
在这个“以瘦为美”的时代,减肥似乎成了全球性的热门话题。健身房里挥汗如雨的人们、各种减肥药的广告,还有那些让人眼花缭乱的节食方案……但你知道吗?科学家们也在为这场“减肥大战”努力着。近日,一篇发表在国际杂志Nature上题为“Prohormone cleavage prediction uncovers a non-incretin anti-obesity peptide”的研究报告中,来自斯坦福大学医学院等机构的科学家们通过研究发现了一个可能改变游戏规则的新分子—BRP(BRINP2相关肽)。
提到减肥药,很多人可能听说过Ozempic(司美格鲁肽),其是一种通过模拟人体内GLP-1(胰高血糖素样肽-1)作用来抑制食欲、降低血糖的药物,而GLP-1是一种调节食欲和血糖的关键激素,Ozempic能通过模仿其效果来帮助人们减少食物摄入,从而达到减肥的目的。然而,Ozempic也有它的“小缺点”,比如可能会引起恶心、便秘,甚至导致肌肉量减少。
这项研究中,研究人员就找到了一个可能更好的替代品—天然分子BRP(BRINP2相关肽),其和Ozempic一样能有效抑制食欲和减少体重,但似乎没有那些让人不舒服的副作用。这简直就是减肥界的“新星”,BRP的发现过程堪称一场“大海捞针”的科学冒险。我们的身体中有成千上万种蛋白质,其中一种叫做“原激素”的蛋白质在经过特定酶的切割后,会变成具有生物活性的肽类激素,这些肽类激素在调节能量代谢、控制食欲等方面起着关键作用。GLP-1就是其中一个例子,但科学家们一直怀疑还有更多类似的肽类激素等待被发现。
【12】Nature:肝癌复发的“预警器”,中国科学家开发出新型复发风险预测平台
doi:10.1038/s41586-025-08668-x
肝细胞癌(HCC,hepatocellular carcinoma)是全球癌症相关死亡的第三大原因,患者术后复发率高达70%。对于肝癌患者而言,手术切除虽然是常见的治疗手段,但复发的阴影始终笼罩在头顶。如果能提前精准预测哪些患者更容易复发,不仅能改善患者的治疗效果,还能更合理地分配医疗资源。
近日,一篇发表在国际杂志Nature上题为“Spatial immune scoring system predicts hepatocellular carcinoma recurrence”的研究报告中,来自中国科学技术大学等机构的科学家们通过研究成功开发了一种基于空间免疫的肝癌复发风险预测平台,这或为解决这一难题带来了新的希望。

空间多组学分析或能揭示NK细胞分布和肝细胞癌复发之间的关联
肝癌的复发问题一直是医学界的难题,尽管手术切除可以有效去除肿瘤,但由于肿瘤免疫微环境(TIME)的复杂性和动态变化,患者发生复发的风险仍然很高。肿瘤免疫微环境是一个充满细胞和信号分子的复杂生态系统,免疫细胞在其中扮演着关键角色;然而传统的病理学方法只能提供有限的信息,难以捕捉到免疫细胞的空间分布和动态变化,这就像是在一个迷宫中寻找出口,但只有一张模糊的地图。
文章中,研究人员所开发的名为TIMES(Tumor Immune MicroEnvironment Spatial,肿瘤免疫微环境空间评分技术)评分系统就像是为这个迷宫提供了一张高清导航图。这个系统能通过整合全切片成像(WSI)和人工智能驱动的空间分析算法全面评估肿瘤与免疫细胞之间的相互作用。研究人员基于五个关键生物标志物(SPON2、ZFP36L2、ZFP36、VIM和HLA-DRB1)的空间表达谱实现了高精度的复发风险预测。其中SPON2被发现是最具预测价值的生物标志物,其在自然杀伤(NK)细胞亚群中的表达模式与肝癌预后密切相关。
【13】Nature:胰腺癌的“变形术”,科学家揭开肿瘤适应性的秘密武器——ecDNA
doi:10.1038/s41586-025-08721-9
胰腺癌,这个被称为“沉默杀手”的癌症,以其难以早期发现和对治疗的惊人适应性而闻名于世。据统计胰腺癌的五年生存率仅为13%,这就使其成为全球最致命的癌症之一。近日,一篇发表在国际杂志Nature上题为“MYC ecDNA promotes intratumour heterogeneity and plasticity in PDAC”的研究报告中,来自意大利维罗纳大学等机构的科学家们通过研究揭示了胰腺癌适应性的关键秘密—细胞外染色体DNA(ecDNA),相关研究结果或为理解胰腺癌的复杂性和寻找新的治疗策略提供了重要线索。
胰腺癌的可怕之处不仅在于其难以发现,还在于肿瘤细胞能够在恶劣环境中“变形”和适应,这种能力就使其在面对治疗时表现出极高的耐药性,科学家们一直试图解开这种适应性的秘密,而本文研究发现,ecDNA可能是关键因素之一。ecDNA是一种存在于细胞核中独立于染色体存在的环状DNA,这种特殊的DNA结构使得肿瘤细胞能够快速调整基因表达从而在不同的微环境中生存。研究人员发现,胰腺癌细胞通过在ecDNA上携带关键癌基因(如MYC)获得巨大的生存优势,MYC基因在癌细胞生长和代谢中起着关键作用,而ecDNA的存在使得MYC基因的拷贝数可以在细胞之间高度变异。
研究者Elena Fiorini博士表示,当MYC基因位于ecDNA上时,其拷贝数的变异性远高于位于染色体上的情况。有些细胞携带了数十甚至数百个额外的MYC拷贝,在某些条件下,这为其提供了巨大的生长优势;这种策略称之为“对冲策略”,即肿瘤内的一部分细胞携带较高水平的MYC来适合某种环境,而另一部分细胞则携带较少的MYC拷贝或许在其它环境中更具优势;这种多样性正是胰腺癌内部异质性的体现,也是其难以治疗的原因之一。
【14】Nature:科学家解锁大脑的社交密码——如何在复杂社交中快速决策?
doi:10.1038/s41586-025-08705-9
社交互动是人类生活中不可或缺的一部分,无论是与朋友的日常交流、工作中的团队合作,还是在国际舞台上与不同文化背景的人打交道,我们的大脑都在不断地处理复杂的社交信息。然而,面对如此多变且复杂的社交场景,我们的大脑是如何高效地跟踪和处理这些信息的呢?近日,一篇发表在国际杂志Nature上题为“Basis functions for complex social decisions in dorsomedial frontal cortex”的研究报告中,来自英国伦敦大学学院等机构的科学家们通过研究揭示了大脑在社交决策中的秘密机制,为理解人类的社交能力提供了新的视角。

群体决策任务和以主体为中心的表示
在日常生活中,我们常常需要快速做出社交决策,比如判断谁在团队中表现更好,或者决定是否信任某个合作伙伴,这些决策背后就大脑需要处理大量的信息,包括每个人的表现、彼此之间的关系及这些信息如何影响最终的决策。然而如果大脑试图记住每一个细节,那么处理这些信息的负担将不堪重负。因此科学家们推测,大脑可能采用了一种更高效的策略来简化信息处理。
为了验证这一假设,研究人员设计了一个简单的游戏实验,让参与者在扫描仪中观察自己、队友和对手的表现,并根据这些信息做出决策。通过功能性磁共振成像(fMRI),研究人员记录了参与者大脑中的活动模式,结果发现,大脑并非简单地记住每个玩家的表现,而是通过一些基本的“信息模块”来理解社交互动的模式,这些模块就像是大脑中的“积木”,可以组合起来帮助我们快速理解复杂的社交场景。
【15】Nature:揭秘儿童多系统炎症综合征幕后黑手——EB病毒与TGFβ的“共谋”
doi:10.1038/s41586-025-08697-6
在新冠疫情的背景下,儿童多系统炎症综合征(MIS-C,Multisystem Inflammatory Syndrome in Children)成为了一个令人揪心的谜团,这种罕见但严重的炎症性疾病通常在儿童感染新冠病毒后的几周内突然发作,可能导致心脏衰竭、皮疹和高烧,甚至危及生命。尽管大多数儿童在感染新冠后症状较轻,但MIS-C的出现却让家长们和医生们如临大敌。然而,直到最近,科学家们才揭开了MIS-C背后的真正“元凶”。
近日,一篇发表在国际杂志Nature上题为“TGFβ links EBV to multisystem inflammatory syndrome in children”的研究报告中,来自德国柏林夏里特大学医学中心等机构的科学家们通过研究揭示了MIS-C的发病机制。研究人员发现,Epstein-Barr病毒(EB病毒,EBV)的再激活是引发MIS-C的关键因素,而新冠病毒感染导致的免疫系统紊乱则为EBV的复活提供了可乘之机。当发生新冠病毒感染后,儿童机体中的TGFβ(转化生长因子β)水平会显著升高,这种分子会抑制免疫细胞的功能从而使其无法有效清除EBV,进而导致病毒的再次增殖和炎症反应的加剧。
这项研究不仅揭示了MIS-C的病因,还为治疗提供了新的思路。研究人员表示,通过阻断TGFβ的作用就能恢复免疫细胞的功能,从而有效控制EBV的再激活和炎症反应。这一发现为开发针对MIS-C的精准治疗方法奠定了基础,同时也为其它与新冠相关的炎症性疾病(如长期新冠)的治疗提供了潜在的方向。(生物谷Bioon.com)
更多精彩阅读:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


