Developmental Cell:研究揭示不同的心外膜基因调控程序驱动斑马鱼心脏的发育和再生
来源:网络 2024-02-01 16:12
近段时间,来自英国牛津大学拉德克利夫医学系的Michael Weinberger教授及团队发现心外膜发育和再生过程中调控蓝图的差异,强调了心脏再生不仅仅是重新激活发育程序。
在哺乳动物中,心脏受伤后的修复能力在出生后迅速下降,与此相反,斑马鱼的心脏可以在整个成年期再生,这为研究心脏再生的内在机制提供了可能。心外膜是包裹脊椎动物心肌的细胞间皮层,对心脏发育至关重要,也是斑马鱼心脏再生的关键所在。活化的心外膜细胞重新进入细胞周期,并重新表达发育基因,活化的心外膜细胞最先迁移到损伤区域,沉积细胞外基质 (ECM) 成分。在心外膜中,许多由激活的成体细胞表达的因子也由发育中的心外膜表达,心外膜在心脏再生和发育过程中的功能非常相似。心外膜在发育和再生过程中发挥重要作用,但人们对这两个过程中驱动心外膜基因表达程序的上游转录调控知之甚少。
近段时间,来自英国牛津大学拉德克利夫医学系的Michael Weinberger教授及团队采用了一种基于心外膜基因表达和染色质可及性图谱的全基因组方法,以构建、比较和对比在胚胎发育和再生过程中专门驱动心外膜基因程序的基因调控网络,旨在证明由 Hif1ab、Nrf1、Tbx2b 和 Zbtb7a 组成的心外膜调控核心在斑马鱼心脏再生过程中的功能重要性。

结果显示,在再生的心外膜基因调控网络中,Hif1ab、Zbtb7a、Tbx2b 和 Nrf1 等 TFs 被认为是中心调控因子,其中 Hif1ab 被认为位于冷冻损伤心外膜调控层次结构的顶端。即使是胚胎和再生心外膜共有的一组转录本,驱动其表达的潜在遗传程序也是不同的。通过基于电穿孔的 Cas9 介导的基因编辑,他们发现在冷冻损伤时靶向 Hif1ab、Nrf1、Tbx2b 和 Zbtb7a 会导致渗入伤口区域的心外膜细胞数量增加和过度纤维化。tcf21 细胞的增加也可能解释了突变体在 22 dpi 时伤口区域覆盖的致密肌肉层增厚的原因。心外膜细胞在心脏损伤后充当信号枢纽,通过视黄酸和神经胶质蛋白1等旁分泌因子刺激心肌细胞增殖。
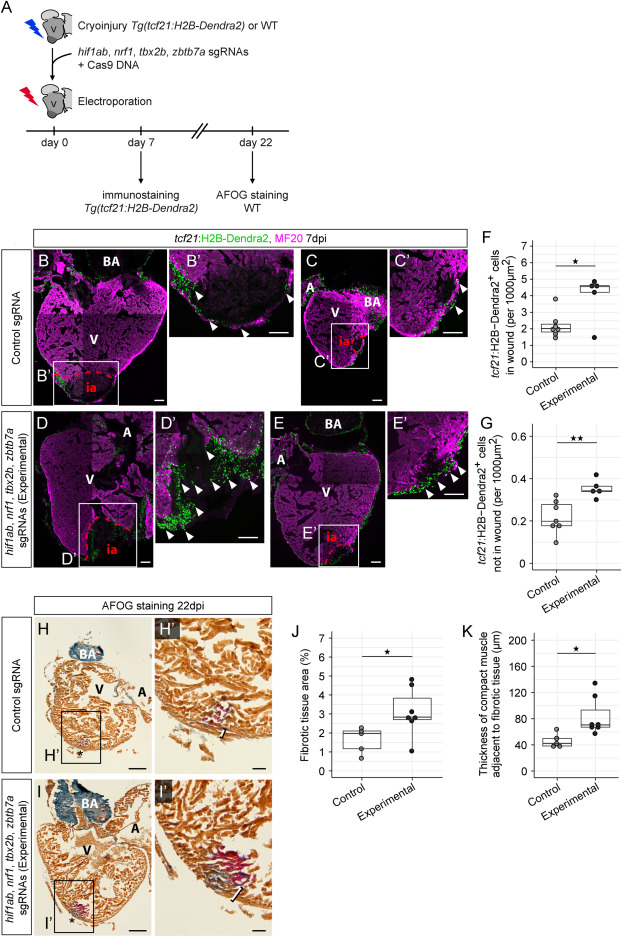
hif1ab、nrf1、tbx2b和zbtb7a缺失影响斑马鱼心脏再生
总之,该团队深入了解了这些过程中的不同调控,并提出心外膜发育的缓慢过程涉及一系列预先计划好的协调事件。深入了解心外膜基因表达动态变化背后的基因调控机制,是开发可诱导非再生哺乳动物心脏再生疗法的关键。
参考文献:
Weinberger M, Simões FC, et. Distinct epicardial gene regulatory programs drive development and regeneration of the zebrafish heart. Dev Cell. 2024 Jan 12:S1534-5807(23)00692-5. doi: 10.1016/j.devcel.2023.12.012. Epub ahead of print. PMID: 38237592.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


