JAMA|中山大学陈旻湖等团队合作提出炎症性肠病治疗新方案
来源:iNature 2023-03-09 14:41
Olamkicept(奥拉奇西普或TJ301)是一种可溶性gp130-Fc-融合蛋白,通过结合可溶性IL-6受体/IL-6复合物选择性地抑制白细胞介素6 (IL-6)反式信号。在无免疫抑制的炎症小鼠模
Olamkicept(奥拉奇西普或TJ301)是一种可溶性gp130-Fc-融合蛋白,通过结合可溶性IL-6受体/IL-6复合物选择性地抑制白细胞介素6 (IL-6)反式信号。在无免疫抑制的炎症小鼠模型中具有抗炎活性。该研究的目的是评价Olamkicept诱导治疗活动性溃疡性结肠炎的疗效。
2023年3月7日,中山大学附属第一医院陈旻湖教授牵头,联合中国大陆19家三甲综合医院、2家台湾地区和1家韩国炎症性肠病(IBD)研究中心在国际知名医学期刊Journal of the American Medical Association 在线发表题为“Effect of Induction Therapy With Olamkicept vs Placebo on Clinical Response in Patients With Active Ulcerative Colitis,A Randomized Clinical Trial”的研究论文,这项随机、双盲、安慰剂对照2期试验纳入91例活动性溃疡性结肠炎且对常规治疗反应不充分的成人。
符合条件的患者被随机分为1:1:1,接受每两周静脉输注600 mg (n = 30)Olamkicept或300 mg (n = 31)Olamkicept或安慰剂(n = 30) 12周。主要终点为第12周时的临床缓解。该研究发现在活动性溃疡性结肠炎患者中,与安慰剂相比,每两周输注600 mg Olamkicept,而不是300 mg,在12周时产生更大的临床反应可能性。需要进一步的研究来进行重复和评估长期疗效和安全性。

溃疡性结肠炎是炎症性肠病的两种主要形式之一,1990年至2016年期间,北美的年发病率为8.8至23.1 / 10万人-年,欧洲为0.97至57.9 /10万 万人-年。溃疡性结肠炎的发病率在中国和韩国等国家呈上升趋势。在中国,预计到2035年,溃疡性结肠炎患者将超过200万,但目前几乎没有高效的治疗方法。溃疡性结肠炎的特征是炎症性病理生理学和粘膜免疫失调,涉及与促炎细胞因子增加和肠粘膜损伤相关的免疫细胞的动态慢性激活。许多抗细胞因子疗法,如抗TNF疗法有显著的不良反应。
白细胞介素6 (IL-6)是一种多效性促炎细胞因子,是慢性炎症的重要中介。经典的IL6信号通过IL-6/IL-6R复合物和信号传感器gp130的2个分子传递。可溶性IL-6R (sIL-6R)起源于膜结合的IL-6R蛋白水解裂解,可形成IL-6/sIL-6R复合物,传递IL-6反式信号。IL-6信号的持续激活触发IL-6R释放,引起IL-6转信号,这主要是慢性炎症的原因。
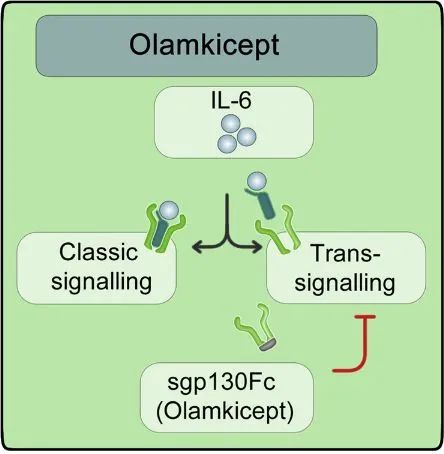
Olamkicept作用模式图
Olamkicept是一类首选的sIL-6R/IL-6复合物选择性抑制剂,是由gp130的2个完整的细胞外结构域与人IgG1 Fc融合形成的二聚体,通过结合并中和sIL-6R/IL-6复合物来抑制IL-6反式信号,但不阻断经典的IL-6信号。一项为期12周的2a期开放标签试验(FUTURE)对16例活动性克罗恩病或溃疡性结肠炎患者进行了研究,结果显示,在一系列结肠镜检查的活检中,黏膜pSTAT3水平发生了明显变化,且与重大安全问题无关。
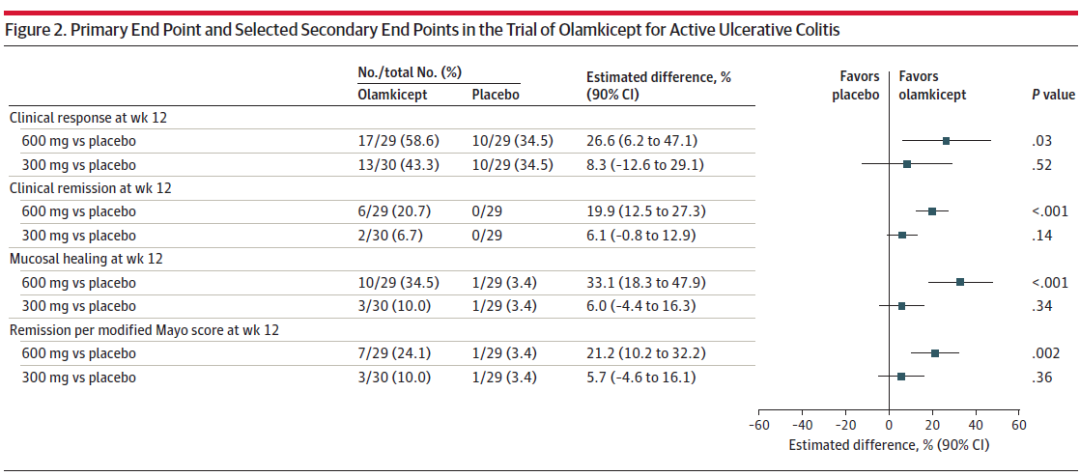
Olamkicept治疗活动性溃疡性结肠炎试验的主要终点和选定的次要终点(图源自Journal of the American Medical Association )
本二期临床试验旨在进一步研究Olamkicept治疗活动性溃疡性结肠炎的疗效。这项随机、双盲、安慰剂对照2期试验纳入91例活动性溃疡性结肠炎(Mayo满分≥5分,直肠出血评分≥1分,内窥镜评分≥2分)且对常规治疗反应不充分的成人。这项研究在东亚的22个临床研究地点进行。患者于2018年2月开始招募。最终随访于2020年12月进行。符合条件的患者被随机分为1:1:1,接受每两周静脉输注600 mg (n = 30)Olamkicept或300 mg (n = 31)Olamkicept或安慰剂(n = 30) 12周。主要终点为第12周时的临床缓解(定义为与基线Mayo总分相比降低≥3和≥30%;范围,0-12[最坏],减少≥1,直肠出血≤1[范围,0-3{最坏}])。有25个次要疗效结局,包括第12周的临床缓解和粘膜愈合。
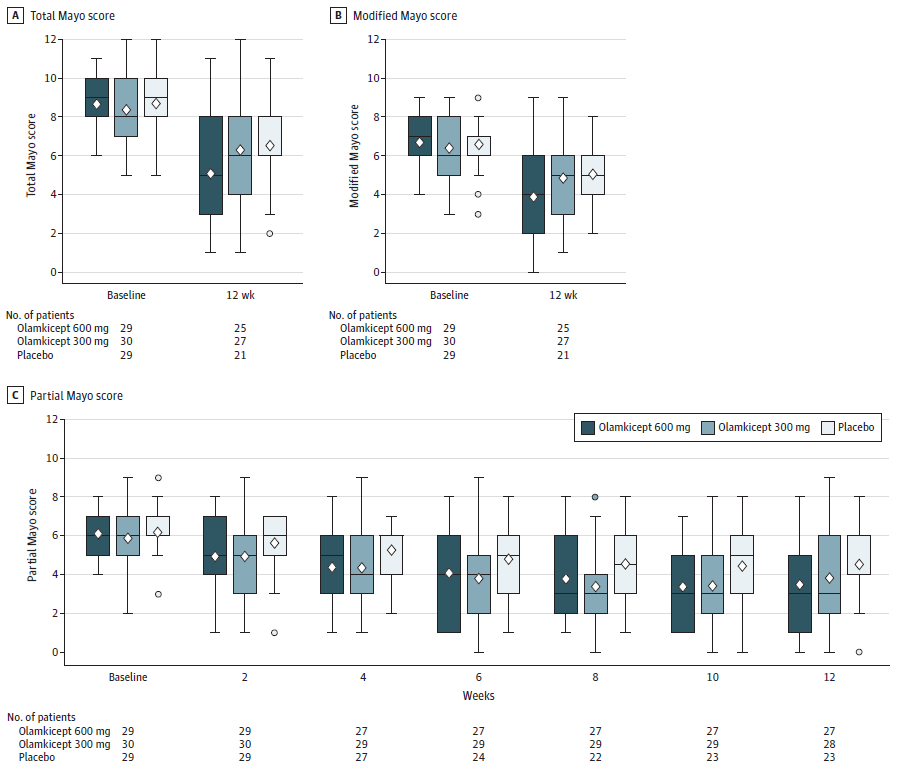
Olamkicept与安慰剂在活动性溃疡性结肠炎随机临床试验中的疗效随时间的变化(图源自Journal of the American Medical Association )
91例患者(平均年龄41岁;25名女性(27.5%)被随机分配;79例(86.8%)完成试验。在第12周,接受Olamkicept 600 mg(17/29[58.6%])或300 mg(13/30[43.3%])的患者比安慰剂(10/29[34.5%])获得了更多的临床缓解,与安慰剂的校正差异为26.6% (90% CI, 6.2%至47.1%;P = .03)和8.3% (90% CI, - 12.6%至29.1%;P = .52)。在随机接受600mg Olamkicept的患者中,25个次要结局中有16个与安慰剂相比具有统计学意义。在随机接受300mg的患者中,25个次要结果中有6个与安慰剂相比具有统计学意义。治疗相关不良事件发生在接受600mg Olamkicept的患者中53.3%(16/30),接受300mg Olamkicept的患者中58.1%(18/31),接受安慰剂的患者中50%(15/30)。最常见的药物相关不良事件是尿中胆红素、高尿酸血症和天门冬氨酸转氨酶水平升高,这些在Olamkicept组比安慰剂组更常见。
在活动性溃疡性结肠炎患者中,与安慰剂相比,每两周输注600 mg Olamkicept,而不是300 mg,在12周时产生更大的临床反应可能性。需要进一步的研究来进行重复和评估长期疗效和安全性。
参考消息:
https://jamanetwork.com/journals/jama/article-abstract/2802060
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


