MC:郑州大学团队发现胃癌免疫治疗新靶点,首次揭示其在塑造胃癌免疫微环境中的作用
来源: 奇点糕 2022-05-06 09:38
胃癌是一种常见的消化道恶性肿瘤,位居我国癌症发病率第3位[1]。FDA批准使用PD-1/PD-L1抑制剂治疗胃癌,但是其客观响应率仅有22%左右[2],因此我们需要对胃癌抵抗免疫治疗的机制做更深入的研
胃癌是一种常见的消化道恶性肿瘤,位居我国癌症发病率第3位[1]。FDA批准使用PD-1/PD-L1抑制剂治疗胃癌,但是其客观响应率仅有22%左右[2],因此我们需要对胃癌抵抗免疫治疗的机制做更深入的研究以开发针对性的疗法。
LSD1是第一个被鉴定出来的组蛋白去甲基化酶,它可以去除组蛋白H3K4上的甲基从而对多种基因的转录进行调控[3,4]。LSD1也可以作为一种癌基因,促进多种肿瘤的发生发展[5,6]。已有的研究表明LSD1可以通过塑造抑制性的肿瘤免疫微环境(TME),来促进神经胶质瘤以及三阴性乳腺癌的发展[7,8],抑制LSD1可以增强抗肿瘤免疫应答,改善PD-1/PD-L1抑制剂的疗效[9,10]。
还有研究显示LSD1在胃癌中表达显著上调,并且LSD1可以促进胃癌细胞增殖与转移,抑制LSD1能够抑制胃癌细胞的增殖与转移活性[11]。但是目前仍不清楚LSD1在胃癌的微环境中是否发挥免疫调节的作用。
近日,郑州大学刘宏民教授和郑一超副教授领衔的研究团队在Molecular Cancer杂志发表研究成果[12]。他们发现,胃癌细胞高表达LSD1可以促进PD-L1在外泌体中的积累,从而抑制T细胞免疫应答。敲除胃癌细胞中的LSD1可以显著增强抗肿瘤免疫应答,抑制肿瘤的生长。
这项研究成果首次揭示了LSD1在塑造胃癌免疫微环境中的作用,提示LSD1或许可以成为胃癌治疗的新靶点。

论文首页截图
研究团队通过分析公共数据库中测序数据发现,LSD1表达水平与胃癌中CD8+T细胞浸润呈负相关。
为了确定肿瘤细胞中LSD1表达是否影响T细胞抗肿瘤免疫应答,研究团队将敲除LSD1的肿瘤细胞系或WT肿瘤细胞系,接种至WT小鼠(615小鼠)或T细胞缺陷的Nude小鼠皮下,观察肿瘤生长趋势。他们发现敲除LSD1的肿瘤细胞在WT小鼠体内的生长明显被抑制,而在Nude小鼠体内则不会。这些结果表明LSD1可能通过抑制T细胞应答来促进肿瘤生长。
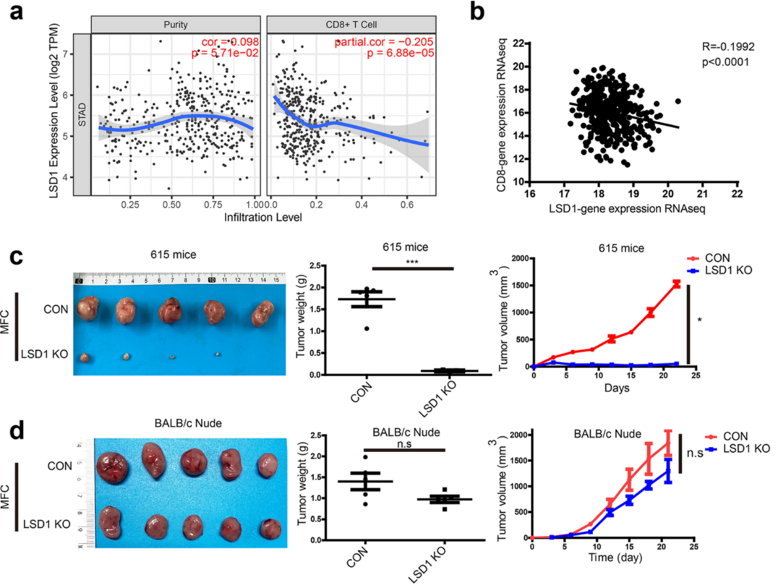
敲除肿瘤细胞中LSD1以T细胞依赖的方式抑制肿瘤生长
由于抑制LSD1可增强抗肿瘤免疫应答,并增强PD-1/PD-L1抑制剂在乳腺癌和黑色素瘤中的抗肿瘤功效[9,10],研究团队推测LSD1可能通过PD-L1抑制T细胞的活化。
为了验证这个猜想,他们对胃癌患者的临床标本进行免疫组织化学染色,结果表明癌组织中LSD1的表达显著高于癌旁组织,并且PD-L1和LSD1的表达呈正相关,而CD8+T细胞的数量与LSD1的表达水平呈负相关。这些结果暗示LSD1和PD-L1之间可能存在调控关系。
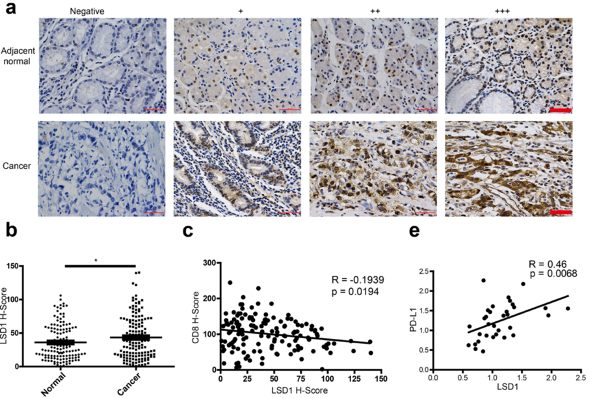
在胃癌患者中,LSD1的表达与PD-L1呈正相关
为了研究LSD1对PD-L1是否具有调节作用,研究团队使用LSD1抑制剂GSK2879552抑制LSD1的功能,或用sgRNA敲低肿瘤细胞系中LSD1的表达,发现抑制/敲低LSD1后PD-L1的mRNA水平显著降低。
不过在使用Western blot检测PD-L1蛋白质水平时发现,抑制/敲低LSD1不影响细胞膜上PD-L1水平,但是显著降低了肿瘤细胞来源的外泌体上的PD-L1水平。这些数据表明LSD1可以调控PD-L1的表达,并且促进PD-L1通过外泌体途径分泌至细胞外。
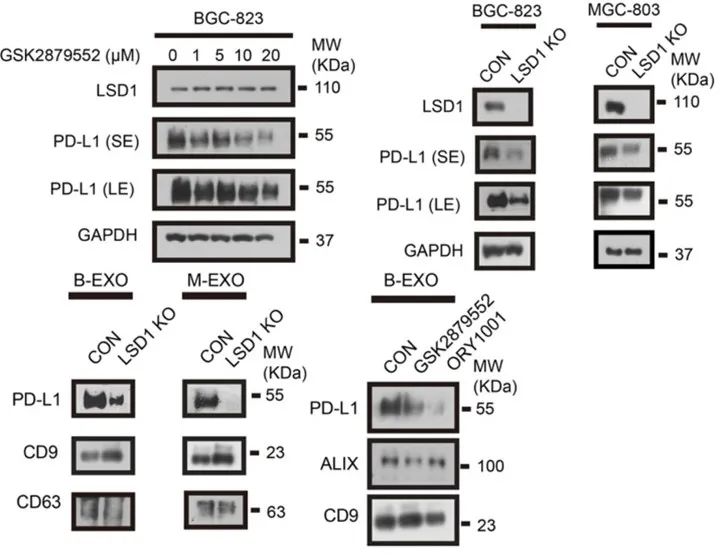
LSD1促进PD-L1通过外泌体分泌至细胞外
那么肿瘤细胞来源外泌体的PD-L1能不能结合T细胞并抑制T细胞的功能呢?
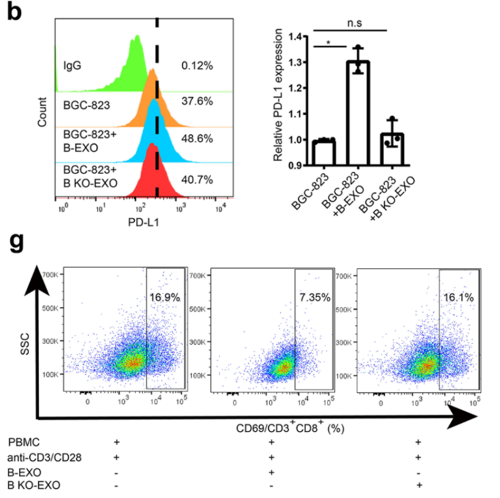
研究团队将来源于胃癌细胞系BGC-823的外泌体(B-EXO)或LSD1-KO BGC-823的外泌体(B KO-EXO)与T细胞共孵育,电镜成像显示B-EXO可以结合至T细胞表面,而B KO-EXO结合能力明显下降。
他们还发现B-EXO可以显著抑制T细胞的活化,而且这种抑制作用可以被PD-L1抗体减弱。而与B KO-EXO孵育的T细胞活化水平则没有显著变化。这些数据表明LSD1促进外泌体中PD-L1水平升高,并以PD-L1依赖的方式抑制T细胞的活化。
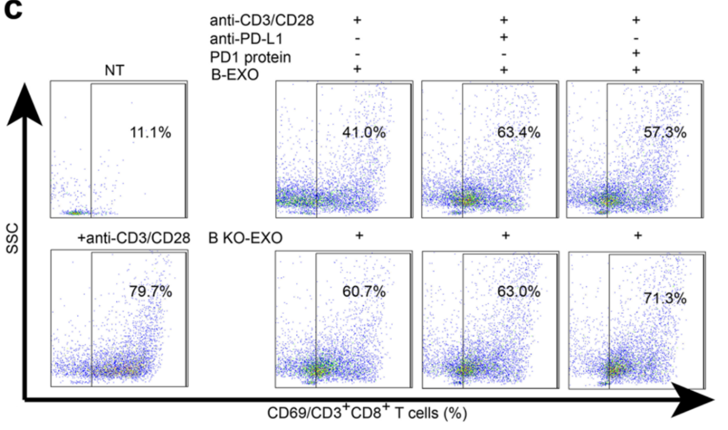
LSD1促进肿瘤细胞来源外泌体以PD-L1依赖的方式抑制T细胞活性
我们都知道外泌体是肿瘤微环境中细胞间通讯的关键参与者,虽然胃癌细胞来源的外泌体可以直接抑制T细胞活化,但外泌体是否可以将PD-L1递送至其他癌细胞,以及LSD1在此过程中的作用仍不清楚。
为了探究这个问题,研究团队将荧光标记的B-EXO和B KO-EXO与低表达PD-L1的胃癌细胞MGC-803共孵育,结果显示B-EXO可以将PD-L1转移至肿瘤细胞膜上,当活化的CD8+T细胞与用B-EXO处理的MCG-803共培养时,其表面活化标志物CD69的表达会显著下调,而与用B KO-EXO处理的MCG-803共培养的T细胞则不受影响。这说明外泌体中的PD-L1可以转运到其他癌细胞中,从而诱导肿瘤免疫逃逸,而LSD1缺陷则减弱了这种作用。
LSD1促进PD-L1以外泌体依赖的方式转移至其他肿瘤细胞表面
以上体外实验证实了LSD1可以增强胃癌细胞来源的外泌体抑制T细胞免疫应答的能力,为了在体内验证以上发现,研究团队构建了皮下瘤小鼠模型。他们发现敲除肿瘤细胞中的LSD1后肿瘤的生长显著减缓;为荷瘤小鼠注射WT肿瘤细胞来源的外泌体显著加速了肿瘤的生长,若同时注射PD-1重组蛋白则可以解除这种加速肿瘤生长的效应。
对肿瘤浸润的免疫细胞进行分析发现,敲除肿瘤细胞上的LSD1后,肿瘤浸润的CD8+T细胞数量显著增加,并且T细胞分泌细胞因子的能力也显著增强。这些结果表明LSD1可以在体内环境中加速肿瘤的生长,这种促肿瘤的作用部分依赖于促进肿瘤细胞分泌PD-L1阳性外泌体抑制T细胞免疫应答。
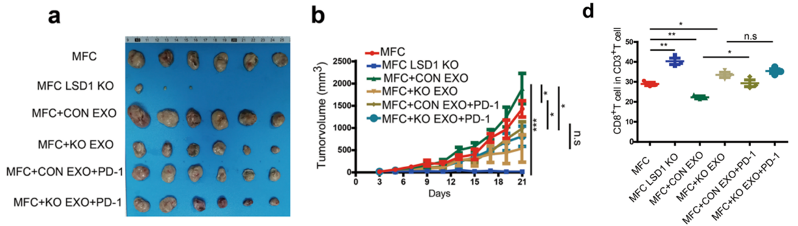
LSD1可以增强胃癌细胞来源的外泌体抑制T细胞免疫应答的能力
总的来说,这项研究表明LSD1可以通过增加外泌体中PD-L1来抑制T细胞抗肿瘤功能。更重要的是,以外泌体为载体,LSD1+肿瘤细胞可以将PD-L1传递给其他肿瘤细胞,进而促进肿瘤的免疫逃逸。
这些发现提示LSD1或许可以作为胃癌治疗的新靶点,同时也期待进一步的研究探索LSD1抑制剂与PD-1/PD-L1抑制剂联用能否改善免疫治疗效果。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


