Nature:汪寅生团队揭示CAG重复扩增的m1A修饰促进神经退行性疾病
来源:生物世界 2023-11-10 14:19
这项研究研究提供了一种新的核苷酸重复扩增导致神经系统疾病的机制范式,并揭示了RNA中m1A的新病理功能。这些发现可能为治疗源于CAG重复扩增的神经退行性疾病提供重要的机制基础。
核苷酸重复扩增导致多种神经系统疾病,例如,C9ORF72基因中GGGGCC六核苷酸重复扩增是肌萎缩侧索硬化症(ALS,也称渐冻症)的主要遗传原因,而CAG重复扩增导致多种神经退行性疾病的发展,包括亨廷顿症(HD)和各种形式的脊髓小脑共济失调(SCA)。
对于由重复扩增引起的神经系统疾病,已经提出了几种机制,包括神经元核内包涵体和淀粉样蛋白聚合物的形成引起的神经毒性,以及随之而来的泛素-蛋白酶体系统的损伤。此外,毒性RNA的积累和异常相分离,以及它们对RNA结合蛋白的隔离,也可能在相关疾病中发挥重要作用。
2023年11月8日,加州大学河滨分校汪寅生教授团队(孙宇翔博士、代慧博士为论文第一作者)在国际顶尖学术期刊 Nature 上发表了题为:m1A in CAG repeat RNA binds to TDP-43 and induces neurodegeneration 的研究论文。
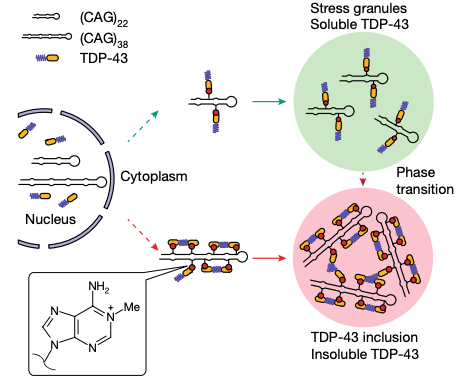
研究团队发现,CAG重复扩增会导致N1-甲基腺嘌呤(m1A)水平的增加,它与TDP-43结合,改变其亚细胞分布和相分离行为,并促进神经退行性疾病。
该研究研究提供了一种新的核苷酸重复扩增导致神经系统疾病的机制范式,并揭示了RNA中m1A的新病理功能。这些发现可能为治疗源于CAG重复扩增的神经退行性疾病提供重要的机制基础。

TDP-43在大脑退行性区域的细胞质错误定位和聚集是许多神经系统疾病的临床标志,包括渐冻症(ALS)、额颞叶变性(FTLD)和CAG重复扩张障碍(例如亨廷顿症、脊髓小脑共济失调)。此外,ATXN2基因中等长度的CAG重复扩增与渐冻症显著相关,而ATXN2基因缺失延长了TDP-43转基因小鼠的寿命并减轻了病理聚集。
TDP-43含有两个RNA识别基(RRM)和一个C端低复杂性结构域(LCD),通过该结构域,蛋白质可以进行分子间相互作用并发生液-液相分离。此外,相分离的RNA-蛋白复合物液滴会随着时间的推移而变得不那么动态和聚集,这表明异常的相分离有助于RNA结合蛋白的聚集。
RNA的动态转录后修饰,特别是N6-甲基腺嘌呤(m6A),是真核生物mRNA上最丰富的化学修饰,构成了调节mRNA稳定性和翻译效率的重要机制,mRNA中这种甲基化修饰的失调与多种人类疾病有关。
在这项最新研究中,研究团队发现,CAG重复扩增会导致N1-甲基腺嘌呤(m1A)水平的增加,它与TDP-43结合,改变其亚细胞分布和相分离行为,并促进神经退行性疾病。
具体来说,该研究揭示了CAG重复扩增的RNA中的腺嘌呤可以被TRMT61A甲基化为N1-甲基腺嘌呤(m1A),并且m1A可以被ALKBH3去甲基化。研究团队还观察到CAG重复扩增RNA中的m1A/腺嘌呤比值随着重复长度的增加而增加,这归因于重复RNA引起的ALKBH3表达的减少。此外,TDP-43与RNA中的m1A直接强烈结合,这刺激了TDP-43的胞质错位和凝胶样聚集物的形成,类似于在神经系统疾病中对该蛋白的观察。研究团队进一步发现,CAG重复扩增RNA中的m1A有助于CAG重复扩增诱导的秀丽隐杆线虫和果蝇的神经退行性病变。
总的来说,这项研究研究提供了一种新的核苷酸重复扩增导致神经系统疾病的机制范式,并揭示了RNA中m1A的新病理功能。这些发现可能为治疗源于CAG重复扩增的神经退行性疾病提供重要的机制基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


