SCI IMMUNOL:约1%的60岁以下危及生命的COVID-19男性患者具有X-连锁隐性TLR7缺乏症
来源:生物谷 2021-08-28 12:41
SARS-CoV-2感染过程中的个体间临床差异很大,危及生命的COVID-19肺炎的最大风险因素是年龄。该研究之前测试了重症流感和重症COVID-19可以是等位基因的假设,并表明危及生命的COVID-19肺炎可由控制Toll样受体3(TLR3)和干扰素凋节因子7(IRF7)依赖型常染色体基因的罕见先天性错误而引起I型干扰素(IFN)免疫。
SARS-CoV-2感染过程中的个体间临床差异很大,危及生命的COVID-19肺炎的最大风险因素是年龄。该研究之前测试了重症流感和重症COVID-19可以是等位基因的假设,并表明危及生命的COVID-19肺炎可由控制Toll样受体3(TLR3)和干扰素凋节因子7(IRF7)依赖型常染色体基因的罕见先天性错误而引起I型干扰素(IFN)免疫。这些疾病在23名17至77岁(平均48岁)的男性和女性中发现,4名年龄在25至50岁之间的无关患者患有常染色体隐性遗传I型干扰素受体(IFNAR1)(n=2)或IRF7(n=2)缺陷。这些患者既往没有严重病毒性疾病的病史,包括流感肺炎,这意味着这些遗传疾病显示出严重流感的不完全外显。这些发现表明依赖TLR3和IRF7的I型IFN免疫对于宿主防御呼吸道SARS-CoV-2感染至关重要。
图片来源:https://doi.org/10.1126/sciimmunol.abl4348
COVID人类遗传努力联盟(www.covidhge.com)招募了一个国际患者队列,目的是调查危及生命的COVID-19肺炎的遗传和免疫学原因。研究者发现该队列中至少10%的患者存在预先存在的针对I型IFN的中和自身抗体,在101名患者中发现了这些自身抗体,其中大部分是男性(95%)和队列的老年成员,其中包括先天性错误的患者,这些发现已在其他五个队列中得到复制。这些研究表明I型干扰素对于呼吸道中对SARS-CoV-2的保护性免疫至关重要,针对I型IFN的自身抗体也为65岁以上患者的性别比例偏倚和高危COVID-19风险提供了第一个解释,而在本文中研究者检验了以下假设,即男性严重的和无法解释的COVID-19肺炎可能是由X染色体上的罕见变异引起的。
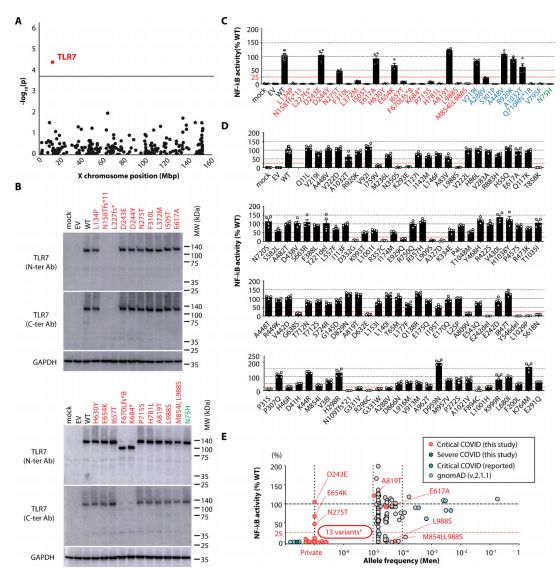

在患有严重COVID-19肺炎的男性中富集罕见的TLR7有害等位基因 图片来源:https://doi.org/10.1126/sciimmunol.abl4348
TLR7是唯一经过多次检测校正后仍然显著的基因,队列中21名无关患者携带一个非常罕见(n=4名患者)、2个非常罕见(n=1名患者)或1个隐性(n=16名患者)非同义变体;在3名患者中发现一种变异(L988S)复发,包括1名携带两种非常罕见变异的患者,而对照组没有发现这些变体。研究者通过用相应的cDNA进行瞬时转染,在没有内源性TLR7和TLR8表达的人胚胎肾(HEK)293T细胞中表达了20个TLR7突变蛋白,使用TLR7特异性mAb对蛋白质提取物进行的免疫印迹表明p.N158Tfs*11和p.L227fs*不存在TLR7蛋白,K684*和F670Lfs*8存在截短的蛋白,而其他突变TLR7蛋白以正常量产生。随后,研究者通过与核因子κB(NF-κB)特异性荧光素酶报告基因共转染来测试它们的功能,发现用R848(TLR7和TLR8的激动剂)刺激后的荧光素酶活性,20个等位基因中有12个是功能丧失的(LOF)(包括2名患者的L988S以及另1名患者的M854I和L988S),3个是亚型(活性< 25%),其余5个是中性的。研究者还进一步发现了有3个隐性变体编码的蛋白质被发现是LOF、由非常罕见的变体(p.A288V)编码的蛋白质是亚型的以及由四个罕见变体编码的蛋白质是中性的。
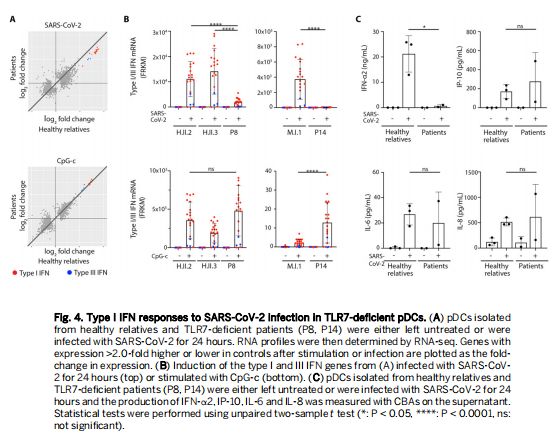
TLR7缺陷pDC对SARS-CoV-2感染的I型干扰素反应 图片来源:https://doi.org/10.1126/sciimmunol.abl4348
解释TLR7缺陷患者COVID-19严重程度的一个合理机制是pDC在SARS-CoV-2刺激下产生I型干扰素的损害,SARS-CoV-2可以进入这些细胞但不能在这些细胞内进行有效复制。研究者之前表明SARS-CoV-2对人类pDC的激活取决于白细胞介素1受体关联激酶4(IRAK4)和内质网膜蛋白(UNC-93B)而不是TLR3,来自TLR7缺陷患者的pDC中17种I型IFN基因的诱导比来自健康个体的pDC弱10-100倍;SARS-CoV-2感染的pDC分泌的I型干扰素的数量,与对照pDC相比,TLR7缺陷型pDC产生的所有13种单独的IFN-α形式的量都显著减少。然而,在SARS-CoV-2感染后TLR7缺陷pDC产生的IFN-α受到损害但并未完全消除,这意味着pDC中也存在SARS-CoV-2的TLR7独立传感器,并表明TLR9 参与其中。TLR7缺陷的pDC对TLR9激动剂的正常反应与这一假设一致,同时也表明TLR9反应的遗传或表观遗传变异可能有助于TLR7缺陷的明显年龄依赖性外显率。
长期以来,人们一直怀疑但从未证明pDC在自然条件下对宿主防御至关重要,遗传性IRF7缺陷是严重流感或COVID-19肺炎的基础,它破坏了pDC以及所有其他细胞类型(包括肺上皮细胞)的I型干扰素的产生。TLR7的先天性错误通过损害血液pDC产生I型干扰素而具有致病性,而pDC在产生大量TLR7和IRF7方面是独一无二的,通过破坏pDC依赖性I型IFN 的产生,XR-TLR7缺陷占60岁以下男性危及生命的COVID-19肺炎病例的至少有1%。(生物谷 bioon)
参考文献
Takaki Asano et al. X-linked recessive TLR7 deficiency in ~1% of men under 60 years old with life-threatening COVID-19. SCIENCE IMMUNOLOGY(2021 Aug 19)doi:https://doi.org/10.1126/sciimmunol.abl4348
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



