揪出阿尔茨海默病的“小刺客”!最新研究:血液细胞外囊泡带 C1q 过血脑屏障,促神经元产 Aβ 加速病情
来源:生物谷原创 2025-09-04 09:00
这项研究无疑为 AD 领域点亮了新的希望,让我们离 “留住记忆” 又近了一步!

“妈,你上周刚办的银行卡怎么又找不到了?”、“爸,我们昨天刚聊过的事,你怎么一点印象都没有?” 生活中,不少人都会经历家人记忆力衰退的场景,起初总以为是 “年龄大了的正常现象”,可随着症状加重,才惊觉可能与阿尔茨海默病(AD)有关。
作为全球最常见的痴呆类型,AD 堪称“记忆的慢性杀手”,它不仅会逐步剥夺患者的认知能力,晚期还会让患者失去生活自理能力,给家庭带来沉重负担。尽管目前已有阿杜卡单抗、莱卡单抗等靶向 Aβ 的药物获批,但它们仅能暂时缓解症状,无法阻止病情进展。这背后的关键问题在于,AD 的病理机制远比 “大脑堆积 Aβ” 复杂——其中,细胞外囊泡(EVs) 与补体 C1q 的角色一直充满争议。
此前研究中,有人认为循环 EVs 会促进 Aβ 生成,也有人称其能帮助清除 Aβ;补体 C1q 同样如此,既有研究说它能保护神经,也有研究指出它会破坏突触。而近期发表在《Journal of Neuroinflammation》的研究,终于厘清了这两个“争议角色”的关联:AD 模型小鼠血液中的细胞外囊泡(APPEVs) ,会携带补体 C1q 跨越血脑屏障,向神经元传递 “异常指令”,促使 Aβ 大量生成。这一发现不仅解开了此前的研究争议,更让细胞外囊泡成为早期 AD 诊断与治疗的新靶点,为对抗 AD 提供了全新方向。

实验意义与目的
此前研究的核心困惑集中在两点:一是循环细胞外囊泡在 AD 中究竟是“保护者”还是“破坏者”?二是补体 C1q 作为免疫系统蛋白,为何会与 Aβ 的生成产生关联?因此,本研究的核心目的明确:验证 AD 模型小鼠的循环细胞外囊泡(APPEVs)是否通过携带特定蛋白(如补体 C1q),激活神经元内的信号通路,最终促进 Aβ 生成与斑块聚集;若成立,则进一步解析其具体作用机制。
实验“阵容”
实验对象:
动物模型:6 月龄雄性 C57BL/6 野生型(WT)小鼠,及同月龄 APP/PS1 转基因 AD 小鼠(该模型会模拟 AD 病理,脑内会出现 Aβ 斑块堆积);14 周龄 APP/PS1 小鼠(用于早期 AD 干预实验,此时尚未形成大量 Aβ 斑块)。
细胞模型:从 WT 与 APP/PS1 小鼠胚胎(E16-17)中提取的原代皮层神经元,用于体外机制验证。
研究整体分为“提取鉴定细胞外囊泡”、“体外验证机制”、“体内验证效果” 三大环节:从 WT 小鼠和 APP/PS1 AD 模型小鼠血浆中,经多步离心与色谱分离,提取出 WTEVs 和 APPEVs,再通过 Western blot、纳米流式细胞仪、透射电镜确认其纯度与身份;体外将原代神经元分四组处理,用多种技术验证 APPEVs 对 Aβ 生成的影响及机制;体内通过给小鼠注射荧光 EV 或不同试剂,观察 EV 跨血脑屏障能力及对脑内 BACE1、Aβ 斑块等的作用。
细胞外囊泡的 “作案细节” 全揭秘
1. AD 小鼠的细胞外囊泡:数量更多,且携带“有害货物” C1q
研究首先确认 APP/PS1 小鼠的 AD 模型有效性:免疫荧光显示,6 月龄 APP/PS1 小鼠海马区出现明显 Aβ 斑块,而 WT 小鼠无此现象,说明模型符合实验要求。
随后对提取的细胞外囊泡分析发现:
数量差异:纳米流式细胞仪结果显示,WTEVs 与 APPEVs 的平均粒径相近(约100nm),但 APPEVs 的浓度显著高于 WTEVs,意味着 AD 小鼠血液中的细胞外囊泡数量更多,相当于 “异常快递” 的总量增加。
内容物差异:通过 LC-MS/MS 蛋白质组学分析,APPEVs 中存在 24 种显著上调的蛋白,其中补体 C1q 的两个亚基(C1qa、C1qb)同时富集于 “神经退行性疾病通路” 与 “免疫系统通路”,是两类通路的交集蛋白。ELISA 进一步验证:APPEVs 中的 C1q 浓度显著高于 WTEVs,而血浆中游离的 C1q(EV-free 组分)在两组小鼠中无差异,说明 C1q 并非游离存在,而是被细胞外囊泡“打包运输”,这也解释了为何此前研究中 C1q 的作用会出现争议——其功能与 “运输载体(EV)” 密切相关。
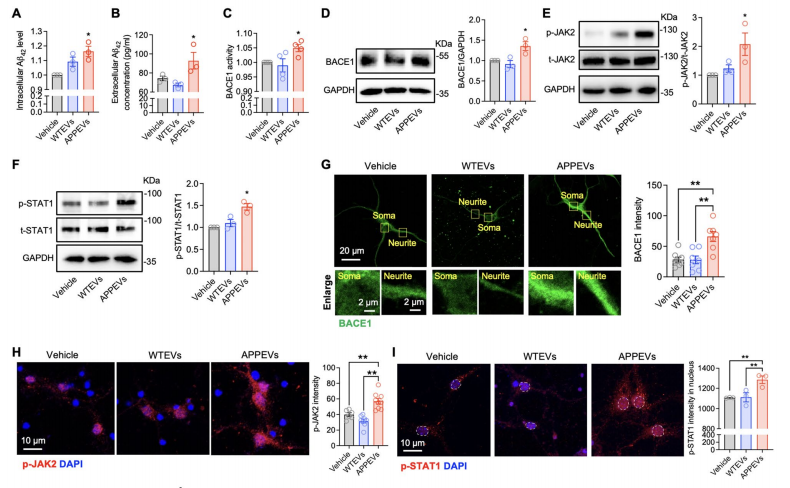
图:APPEV通过JAK2-β-BACE1信号通路诱导神经元A-STAT42的产生
2. APPEVs 通过激活 JAK2-STAT1 通路,促进神经元产 Aβ
体外实验中,APPEVs 对神经元的影响十分明确:
Aβ42 大量生成:ELISA 结果显示,与对照组和 WTEVs 组相比,APPEVs 处理后,原代神经元内与培养液中的 Aβ42 浓度均显著升高。Aβ42 是 AD 中毒性最强的 Aβ 亚型,其增多直接意味着神经元的病理损伤风险上升。
BACE1 活性与表达上调:BACE1 是 APP 切割生成 Aβ 的关键酶(β- 分泌酶),荧光试剂盒检测发现,APPEVs 组的 BACE1 活性显著高于其他组;Western blot 结果也显示,APPEVs 组的 BACE1 蛋白表达量更高,说明 APPEVs 通过提升 “产毒工具” BACE1 的水平,促进 Aβ 生成。
JAK2-STAT1 通路被激活:Western blot 显示,APPEVs 处理后,神经元内 p-JAK2(JAK2 激活形式)与 p-STAT1(STAT1 激活形式)的水平显著升高,而总 JAK2、总 STAT1 无明显变化;免疫荧光进一步观察到,p-STAT1 向细胞核内转移,而细胞核分离实验也确认 APPEVs 组的核内 p-STAT1 增多。更关键的是,加入 JAK2 抑制剂 XL019 或 STAT1 抑制剂氟达拉滨后,APPEVs 诱导的 BACE1 上调被完全抑制,说明 APPEVs 是通过激活 JAK2-STAT1 通路,调控 BACE1 表达,进而促进 Aβ 生成——这一通路是 APPEVs 发挥作用的 “核心指令链”。
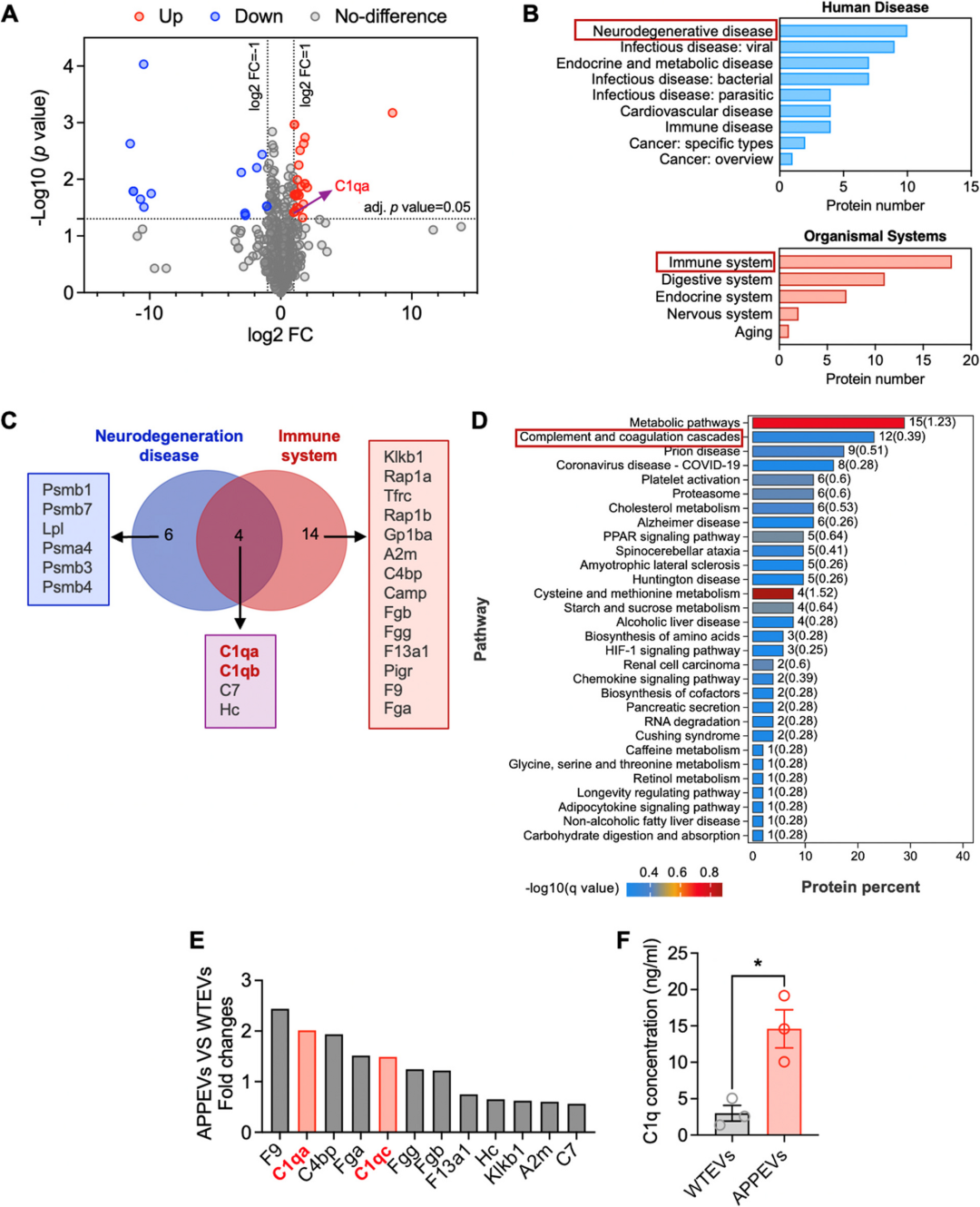
图:蛋白质组学分析表明,APPEV含有更多的C1q补体
3. C1q 是 APPEVs 中的 “关键帮凶”,缺失则无法促 Aβ
为验证 APPEVs 中 C1q 的作用,研究加入了 C1q 抑制剂:
结果显示,C1q 抑制剂处理后,APPEVs 诱导的神经元内、外 Aβ42 升高被完全阻断;BACE1 的活性与蛋白表达也恢复至对照组水平;同时,p-JAK2 与 p-STAT1 的水平显著下降,p-STAT1 的核转移也被抑制。
此外,免疫荧光观察 APP 与 BACE1 在脂质筏(GM1 标记)的定位发现,APPEVs 会促进 APP 与 BACE1 在脂质筏共定位(利于 APP 切割),而加入 C1q 抑制剂后,这种共定位消失。且 LDH 实验显示,C1q 抑制剂本身不影响神经元存活,排除了 “抑制剂毒性干扰结果” 的可能。这表明,细胞外囊泡携带的 C1q 是激活 JAK2-STAT1 通路、促进 Aβ 生成的关键,没有 C1q,APPEVs 就无法发挥有害作用。
4. APPEVs 可跨越血脑屏障,在体内促进 Aβ 斑块形成
体内实验进一步证实了 APPEVs 的 “破坏力”:
跨越血脑屏障且不破坏屏障:给 WT 小鼠尾静脉注射荧光标记的 WTEVs 或 APPEVs,3 小时后大脑中可检测到明显荧光,而游离荧光染料(PBS-DiR)组无荧光,说明细胞外囊泡可跨越血脑屏障;同时,免疫荧光检测血管内皮紧密连接蛋白 CLDN1 与 JAM-A 发现,WTEVs 与 APPEVs 组的蛋白表达与对照组无差异,意味着 EV 跨越血脑屏障时不会破坏屏障完整性,是“悄悄偷渡”进入大脑。
体内促进 Aβ 斑块形成:对 14 周龄 APP/PS1 小鼠的干预实验显示,20 周龄时,APPEVs 组的神经元 BACE1 表达显著高于对照组与 WTEVs 组,而 “APPEVs+C1q 抑制剂” 组的 BACE1 表达恢复正常;同时,APPEVs 组海马区的 Aβ 斑块数量更多、面积更大,C1q 抑制剂则完全阻断了这一效果。RT-qPCR 结果还显示,各组小鼠脑内的炎症因子(IL-6、IL-12b、TNF-α、IFN-γ)与内源性 C1q(C1qa)mRNA 水平无差异,说明 APPEVs 是通过自身携带的 C1q 发挥作用,不会引发额外神经炎症,也不会诱导大脑自身合成 C1q,结果更具特异性。
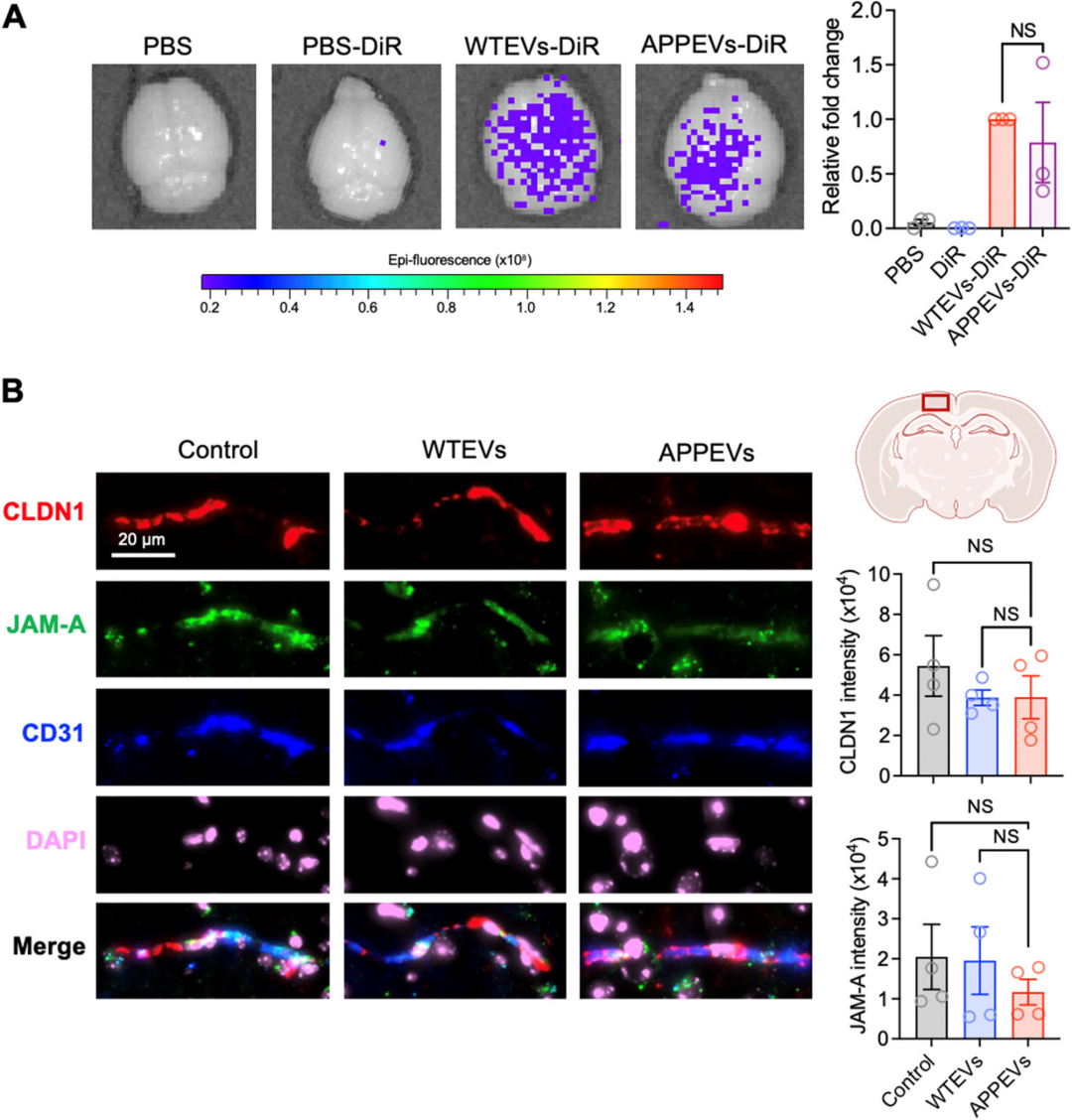
图:血浆EVS能穿透脑组织而不破坏血脑屏障
为何细胞外囊泡与 C1q 的作用此前“正反不一”?
此前研究中,细胞外囊泡与 C1q 的作用之所以存在争议,核心原因在于 “载体与环境差异”:正常状态下,WT 小鼠的细胞外囊泡(WTEVs) 不携带 C1q,可能通过其他 cargo 帮助清除 Aβ;而 AD 状态下,APPEVs 携带 C1q,定向作用于神经元,激活有害通路。
C1q 的争议也同理:游离的 C1q 可能参与 Aβ 清除或突触保护,但若被细胞外囊泡“精准投递” 到神经元,就会成为 “有害信号”,激活 JAK2-STAT1 通路促 Aβ 生成。这就像 “同一包裹,送对地方是帮助,送错地方是麻烦”,而细胞外囊泡正是决定 C1q “送达地址” 的关键载体。
小结
这篇研究用清晰的实验,揭露了细胞外囊泡在 AD 中的 “作案逻辑”:AD 小鼠血液中的 APPEVs,携带补体 C1q 跨越血脑屏障,进入大脑后激活神经元的 JAK2-STAT1 通路,促使 BACE1 表达升高,进而加速 APP 的 β 切割,生成更多 Aβ42,最终导致 Aβ 斑块堆积——整个过程就像 “有害快递” 精准投递 “坏包裹”,触发大脑内的 “产毒流水线”。
这一发现的价值不仅在于解开了此前的研究争议,更给 AD 防治带来两大新方向:一是诊断层面,未来或许只需检测血液中细胞外囊泡的 C1q 水平,就能早期发现 AD 迹象,避免 “等出现记忆问题才就诊” 的被动局面;二是治疗层面,可通过 “拦截携带 C1q 的 APPEVs” 或 “阻断 JAK2-STAT1 通路”,从源头减少 Aβ 生成,比现有 “清理已形成的 Aβ” 策略更具前瞻性。总之,这项研究无疑为 AD 领域点亮了新的希望,让我们离 “留住记忆” 又近了一步。
参考文献:
Yu Y, Xiao W, Ma Z, Yi X, Zhong T, Li Z. Circulatory extracellular vesicles transport complement C1q for promoting neuronal amyloid-β production in Alzheimer's disease. J Neuroinflammation. 2025 Aug 29;22(1):209. doi: 10.1186/s12974-025-03528-x. PMID: 40883774; PMCID: PMC12395740.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


