填补缺失的关键环节:何川团队揭示染色质上m6A识别蛋白RBFOX2及其在白血病中的作用
来源:生物世界 2023-09-01 11:33
这项研究表明了YTHDC1与PRC2复合物相互作用以抑制髓系细胞中染色质的可及性。当YTHDC1被募集到基因启动子区域时,不仅使m6A修饰的启动子相关RNA(paRNA)不稳定
芝加哥大学何川教授、陈梦洁教授、希望之城医疗中心贝克曼研究所陈建军教授合作,在 Nature Cell Biology 期刊发表了题为:RBFOX2 recognizes N6-methyladenosine to suppress transcription and block myeloid leukaemia differentiation 的研究论文。
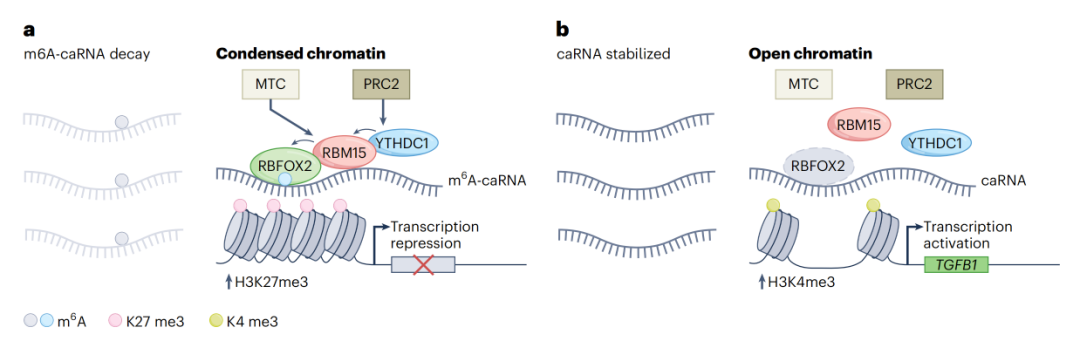
该研究揭示了一个涉及甲基转移酶复合物(MTC)、“阅读器”YTHDC1和RNA结合蛋白RBFOX2的转录调控轴——RBFOX2将MTC组分RBM15招募到启动子相关RNA(paRNA)进行甲基化。RBM15进一步与YTHDC1相互作用,招募PRC2到RBFOX2结合位点进行转录抑制。RBFOX2-m6A-RBM15-YTHDC1-PRC2轴在髓系白血病中发挥重要作用,RBFOX2的下调显著抑制急性髓系白血病(AML)细胞的存活/增殖,并促进AML细胞的髓系分化。
因此,RBFOX2被确定为一个染色质因子,在位点特异性染色质调控过程中促进m6A在染色质相关RNA(caRNA)上的积累。RBFOX2在急性髓系白血病(AML)中过表达,通过阻断髓系分化来维持白血病干细胞(LSCs)的生长和自我更新,为白血病的治疗提供了新的潜在靶点。

该研究将一种已被充分研究的RNA结合蛋白RBFOX2鉴定为一种染色质因子,其优先识别染色质相关RNA(caRNA)上的m6A,RBFOX2可以募集甲基转移酶复合物(MTC)组分RBM15来促进启动子相关RNA(paRNA)的甲基化。RBM15还与YTHDC1相互作用,并招募PRC2到RBFOX2结合位点,从而进行染色质沉默和转录抑制。
此外,该研究还发现了RBFOX2-m6A-RBM15-YTHDC1-PRC2轴在髓系白血病中发挥关键作用。RBFOX2的下调显著抑制急性髓系白血病(AML)细胞的生存/增殖并促进其髓系分化。RBFOX2也是白血病干细胞(LSCs)/起始细胞的自我更新和急性髓系白血病的维持所需要的。
髓系白血病中RBFOX2与m6A修饰的caRNA的结合调控基因表达
这项研究表明了YTHDC1与PRC2复合物相互作用以抑制髓系细胞中染色质的可及性。当YTHDC1被募集到基因启动子区域时,不仅使m6A修饰的启动子相关RNA(paRNA)不稳定,还介导H3K27三甲基化从而抑制转录,而这一过程依赖于RBFOX2。因此,该研究揭示了RBFOX2作为染色质上的m6A结合蛋白,发挥了促进染色质相关RNA(caRNA)甲基化从而抑制转录的功能。这种调控模式填补了染色质和caRNA的m6A甲基化之间相互作用的关键缺失环节。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


