Bioactive Materials 重磅发现!纳米囊泡搭载“再生因子”,让受损牙周“重获新生”
来源:生物谷原创 2025-12-11 09:19
本研究发现miR-423-5p是小细胞外囊泡中促进牙周膜细胞成骨分化的关键成分,工程化富集该分子的囊泡可靶向PLCB1、扩增Sfrp2+成骨成纤维细胞,高效推动牙周再生,为牙周炎治疗提供新策略。
刷牙出血、牙龈红肿、牙齿松动……牙周炎不仅困扰着无数人的日常口腔健康,更会悄悄侵蚀牙骨质、牙周膜和牙槽骨,最终导致牙齿脱落。传统治疗多依赖洗牙、药物或手术修补,却难以让受损的牙周组织实现真正的生理性再生,许多患者只能眼睁睁看着牙齿一步步“失守”。
近日,发表于Bioactive Materials的一项创新性研究带来了转机——通过纳米级工程化囊泡技术,成功实现牙周组织的精准再生,为牙周炎治疗开辟了全新路径。

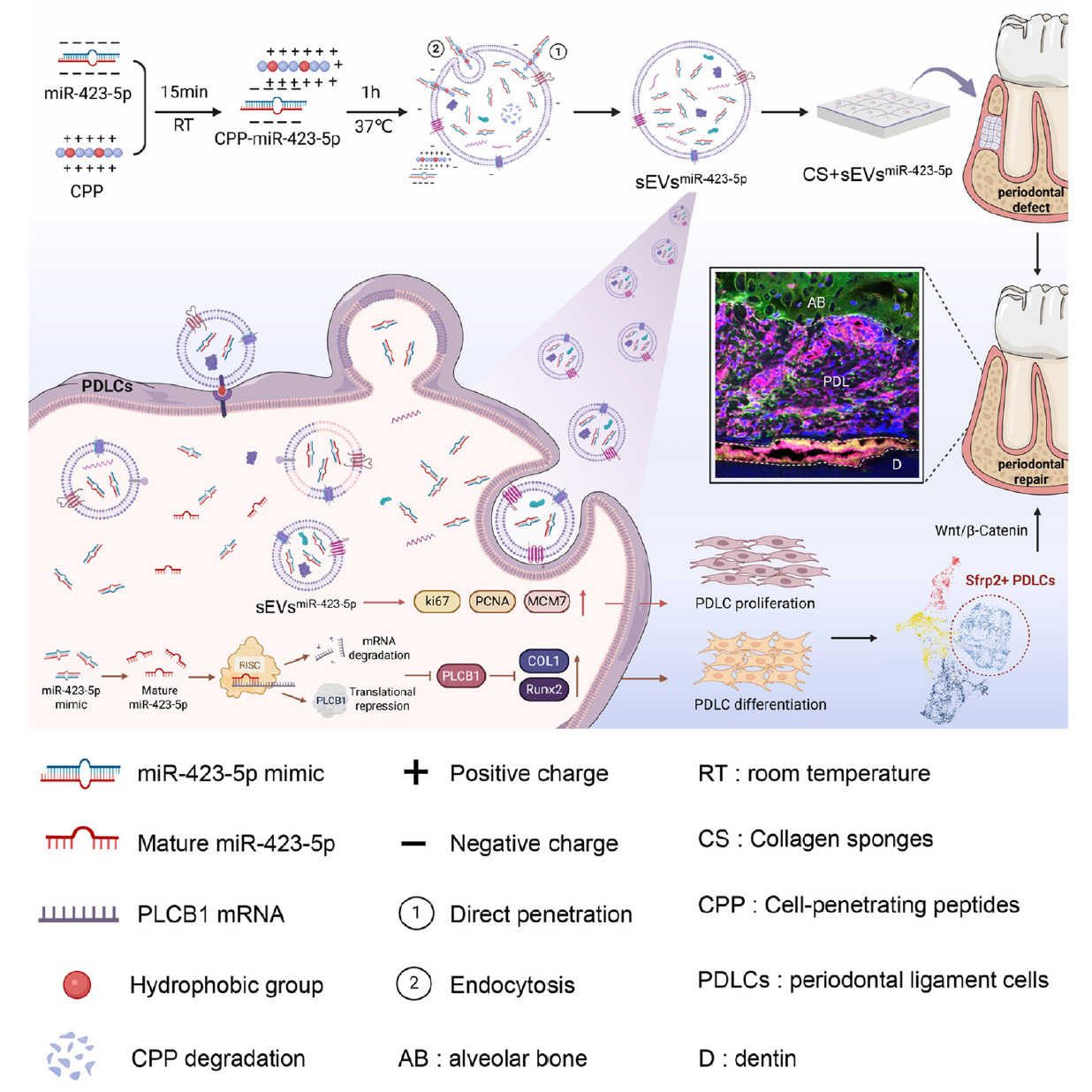
图1 示意图
研究团队首先对多种干细胞来源的小细胞外囊泡展开筛选,涵盖脂肪间充质干细胞、骨髓间充质干细胞、脐带间充质干细胞及牙囊干细胞。结果显示,牙囊干细胞来源的小细胞外囊泡(DFSC-sEVs)表现最为突出,不仅能被牙周膜细胞快速识别并摄取,还能显著提升细胞碱性磷酸酶活性,促进矿化结节形成,成为后续研究的核心载体。
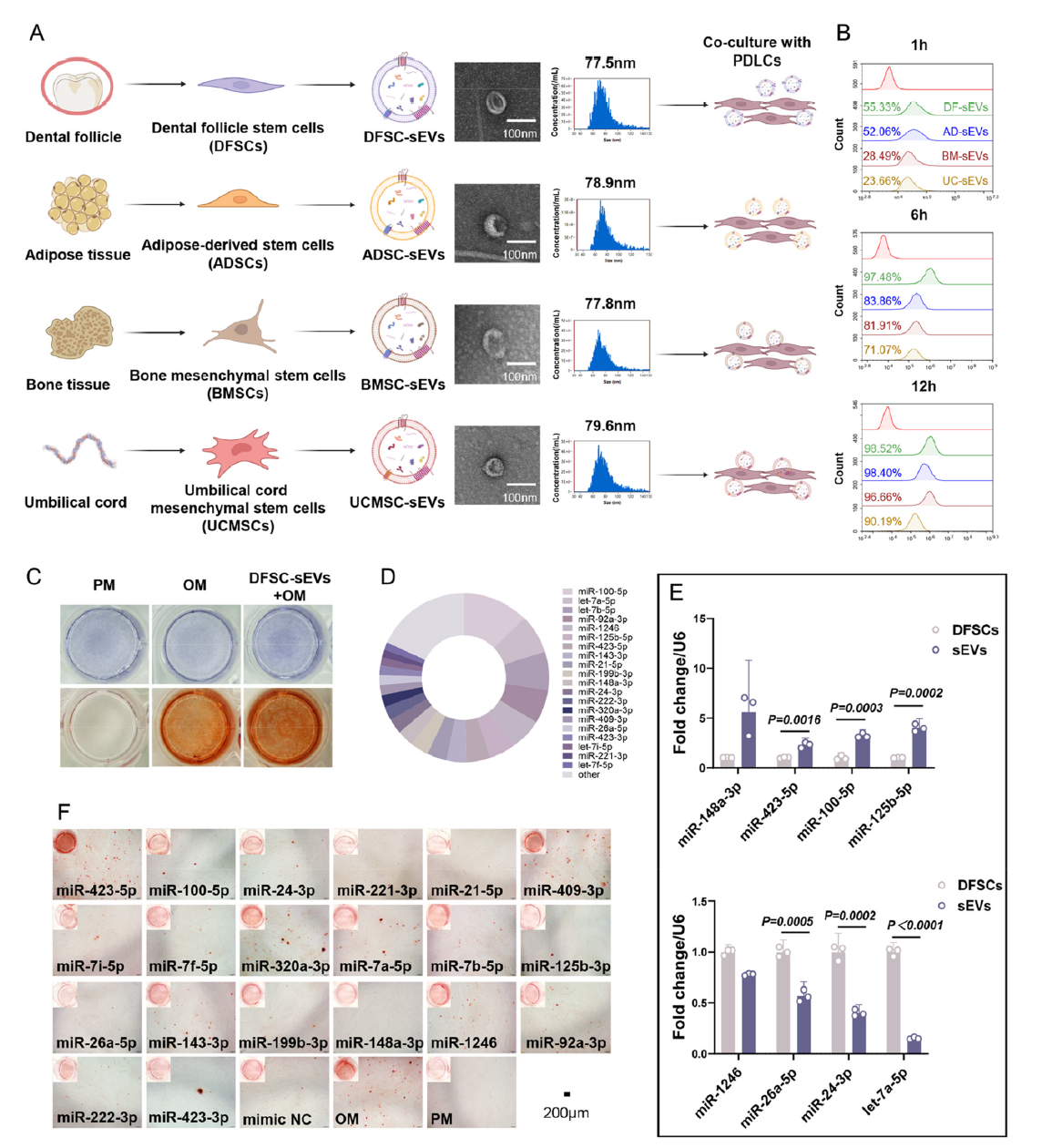
图2 牙囊干细胞来源小细胞外囊泡的功能及微小RNA表达谱分析
借助高通量测序与功能验证实验,研究人员从DFSC-sEVs的高丰度微小RNA中,锁定了miR-423-5p这一核心功能分子。实验证实,过表达miR-423-5p可显著推动牙周膜细胞进入增殖周期,上调增殖标志物表达,同时增强成骨相关基因Runx2和胶原蛋白I的表达;而抑制该分子则会明显削弱成骨分化能力,明确了其在牙周再生中的关键作用。
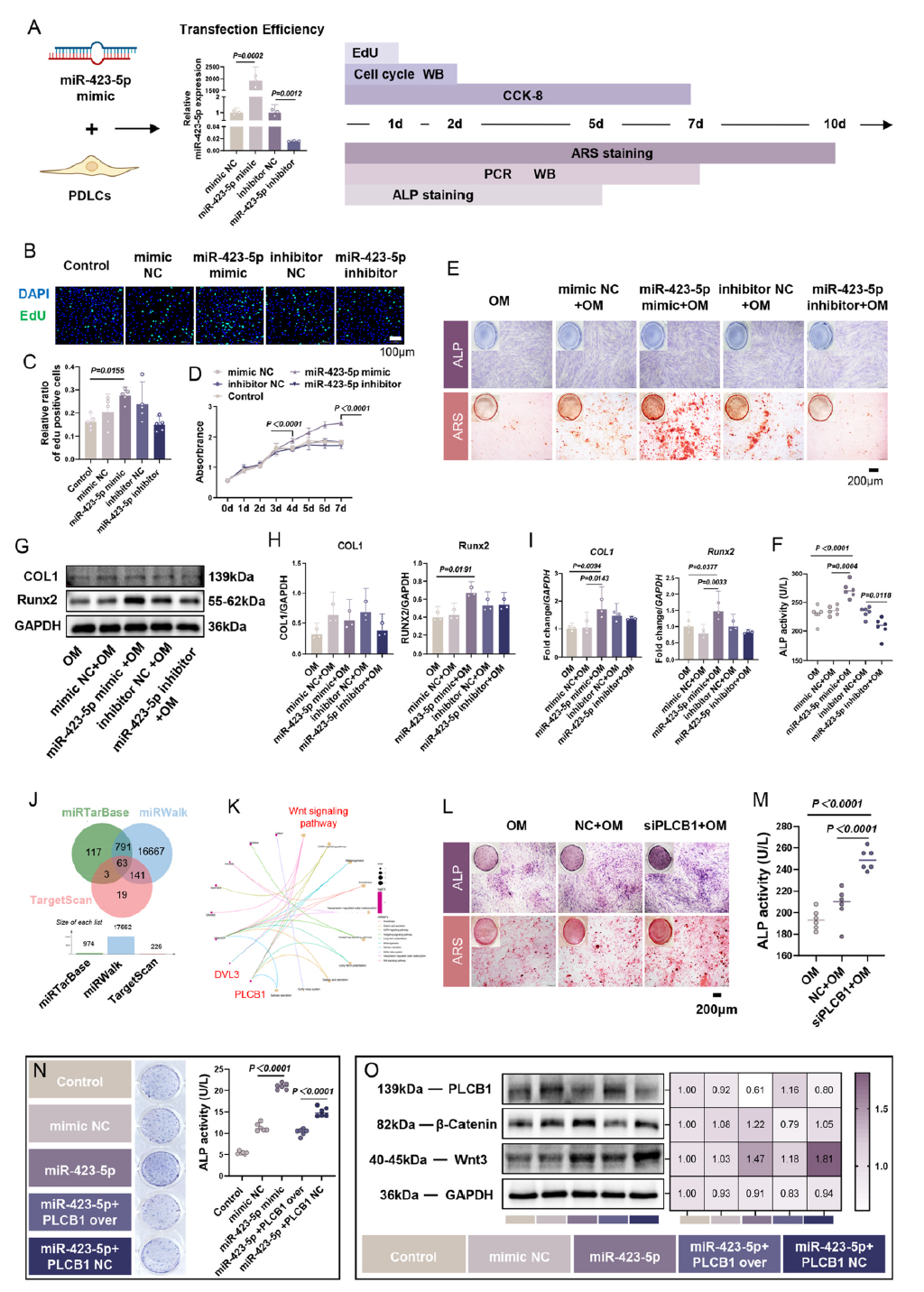
图3 miR-423-5p被鉴定为小细胞外囊泡中的关键成骨因子
miR-423-5p的作用机制也得到清晰解析。通过靶基因预测与验证,研究人员发现它能直接靶向磷脂酶Cβ1(PLCB1)。抑制PLCB1可激活经典Wnt/β-连环蛋白信号通路,进而加速牙周膜细胞成骨分化,而PLCB1过表达则会逆转miR-423-5p的成骨促进效应,这一明确的靶向调控轴为工程化改造提供了精准靶点。
为进一步强化治疗效能,研究团队采用细胞穿透肽介导的外源装载策略,成功构建了miR-423-5p富集的工程化小细胞外囊泡(sEVsmiR-423-5p)。该囊泡完整保留了天然小细胞外囊泡的形态、尺寸及标志物表达特征,而miR-423-5p的装载量较天然囊泡提升高达10万倍,为高效治疗奠定了坚实基础。
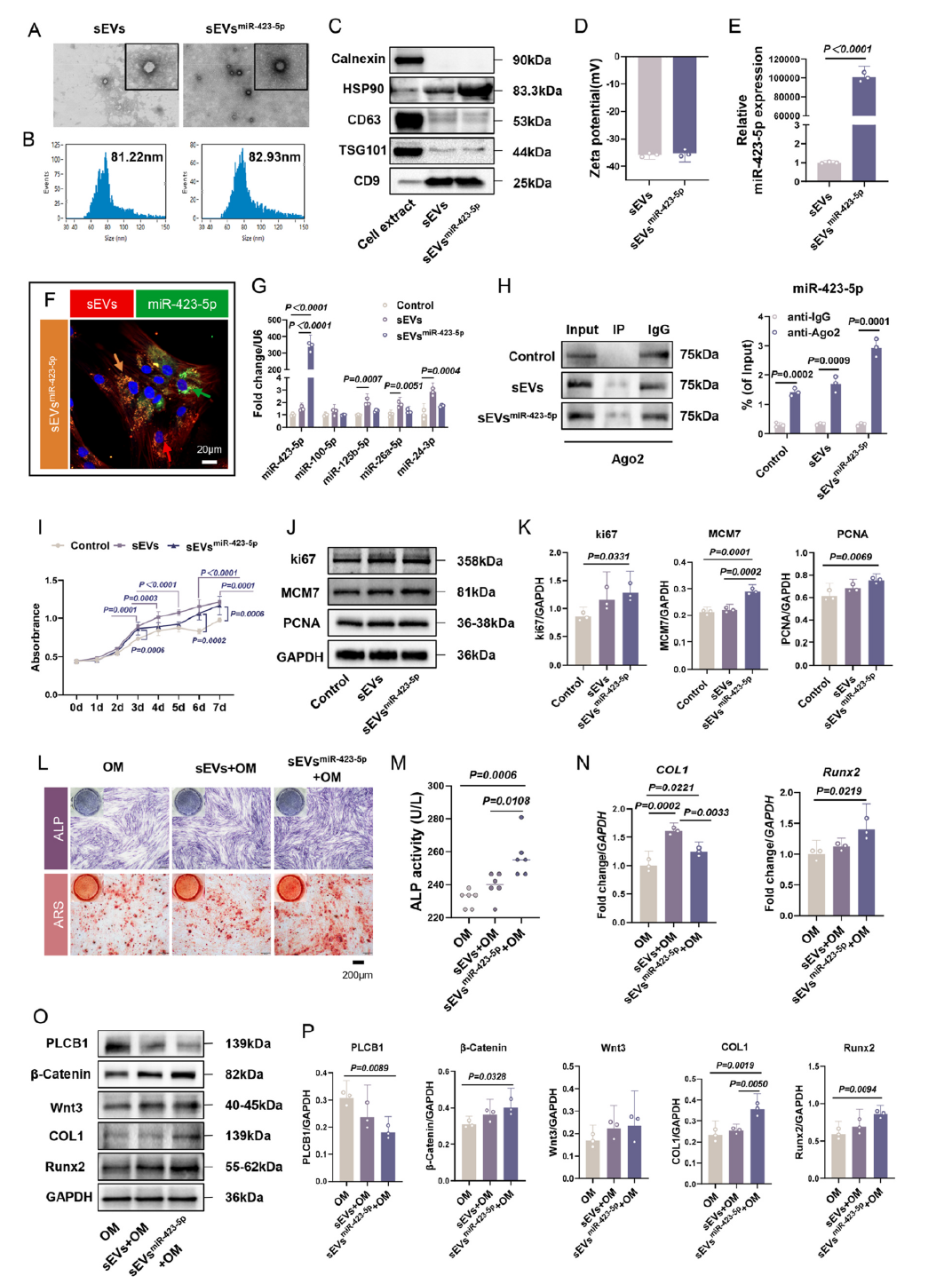
图4 富集miR-423-5p的工程化小细胞外囊泡增强了成骨分化潜力
体外实验证实,sEVsmiR-423-5p能被牙周膜细胞高效摄取并稳定释放miR-423-5p,且不会干扰其他miRNA的正常表达。与传统脂质体转染相比,sEVsmiR-423-5p凭借双层膜结构的保护,可在细胞内持续发挥作用,14天后仍能检测到有效分子活性,显著降低了miRNA的降解风险。同时,它能持续激活Wnt/β-连环蛋白通路,成骨诱导效果远超天然小细胞外囊泡。
在大鼠牙周缺损模型中,研究团队将负载sEVsmiR-423-5p的胶原海绵植入缺损部位。胶原海绵作为生物相容性优良的载体,实现了囊泡的局部持续释放,72小时内即可完成有效载荷的全面释放。术后2周,sEVsmiR-423-5p组便出现连续板层骨形成;4周时缺损闭合率显著提升;6周时再生骨密度已与周围正常骨组织接近,且形成了类似天然牙骨质-牙周膜-牙槽骨的复合结构,再生效果全面优于其他实验组。
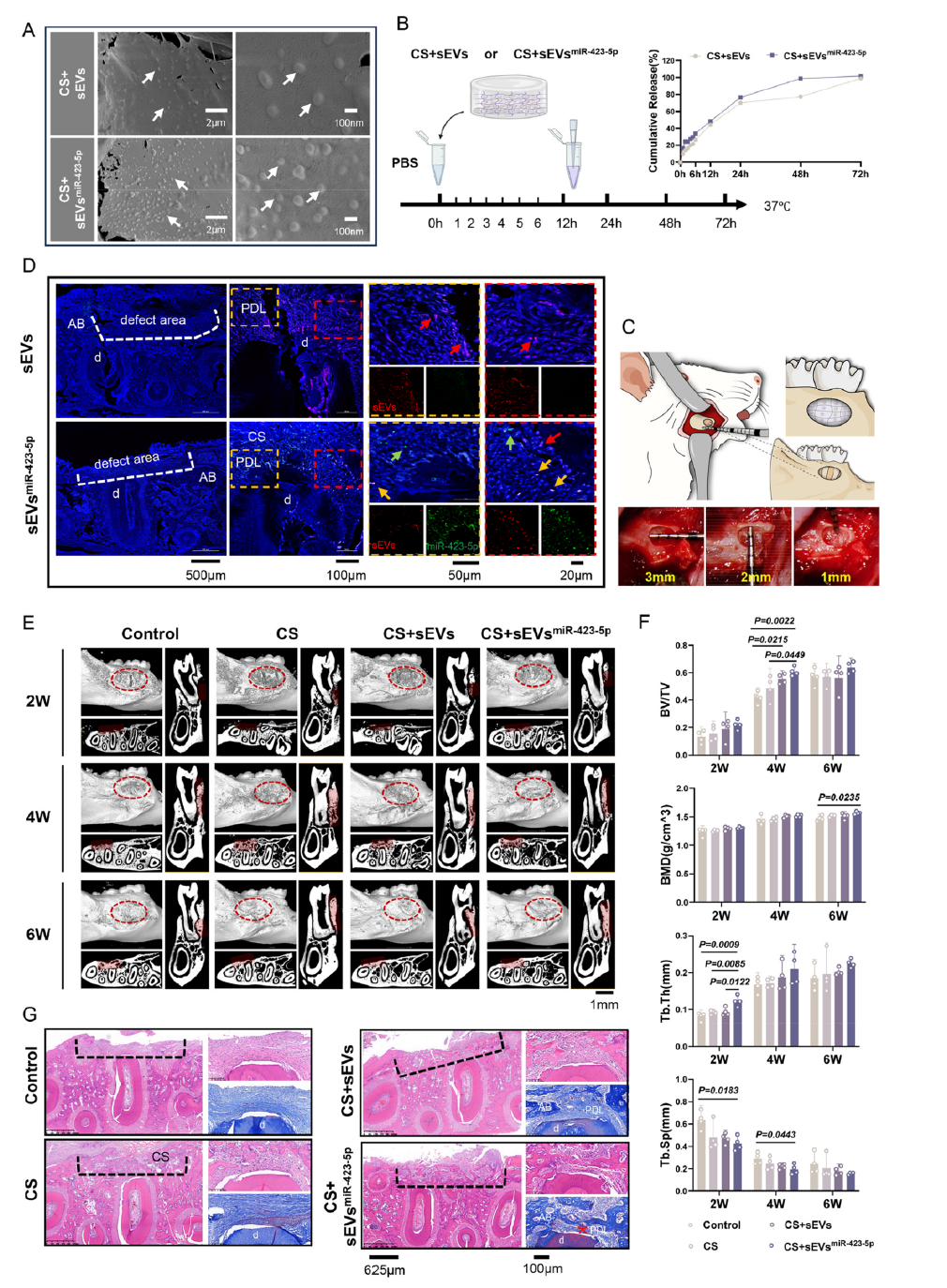
图5 富集miR-423-5p的工程化小细胞外囊泡促进大鼠牙周再生
单细胞RNA测序分析揭示了再生机制的核心:sEVsmiR-423-5p可显著扩增牙周缺损部位的Sfrp2+成骨成纤维细胞。这类细胞具有高干细胞特性和分化潜能,富集于Wnt信号调控及骨发育相关通路。免疫荧光染色证实,Sfrp2与β-连环蛋白在缺损牙本质表面共定位,形成类似天然牙周组织的三明治结构,为再生效果提供了关键结构支撑。
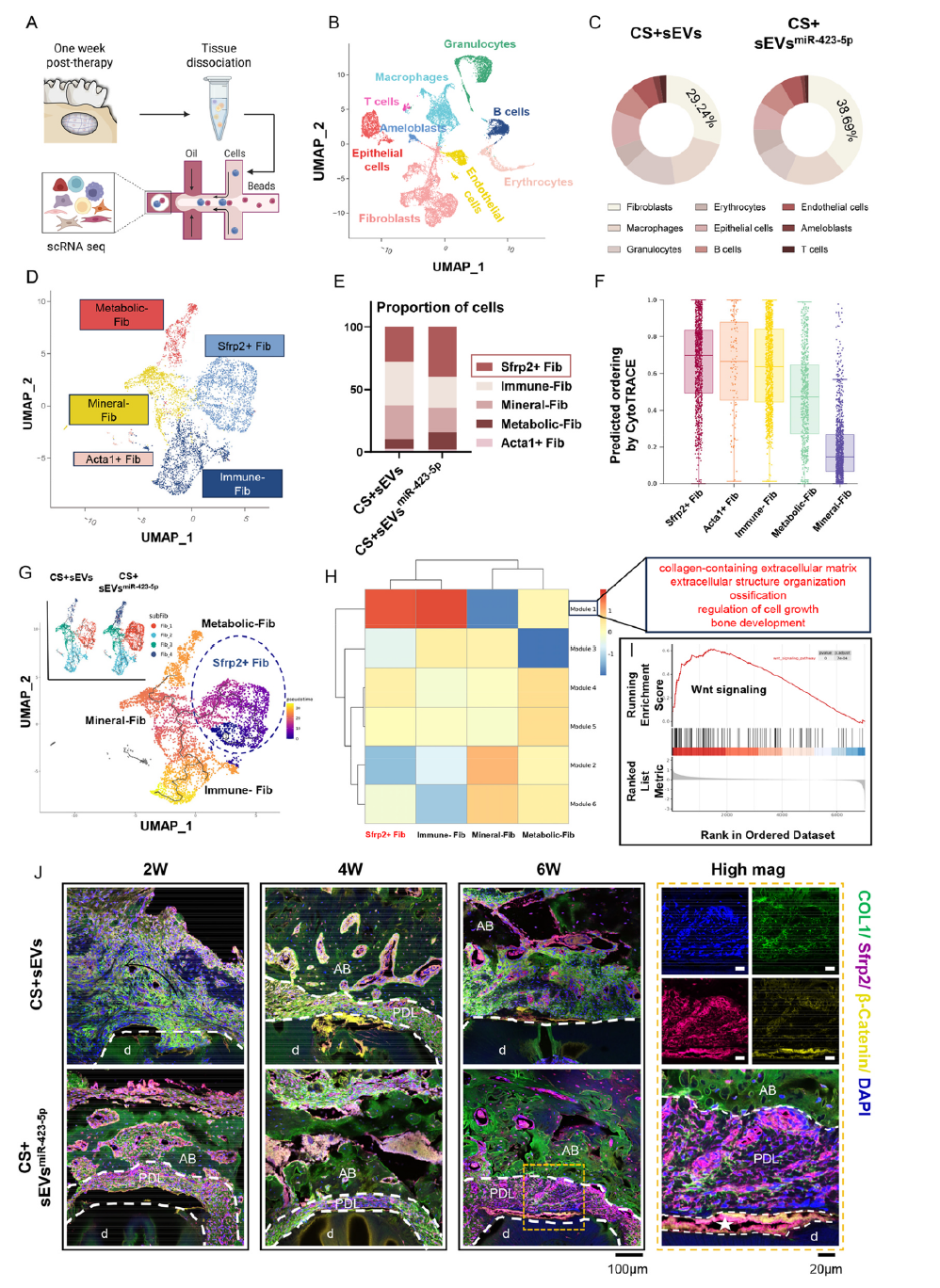
图6 富集miR-423-5p的工程化小细胞外囊泡介导的牙周再生涉及Sfrp2+成纤维细胞扩增
这项研究通过系统筛选与精准工程化改造,不仅明确了miR-423-5p在牙周再生中的核心作用,更成功构建了靶向性强、效能高的工程化小细胞外囊泡治疗体系。其创新之处在于精准锁定关键功能分子并实现高效富集,同时阐明了Sfrp2+细胞扩增介导的再生机制,为牙周炎提供了全新的细胞-free治疗思路。
随着工程化囊泡制备技术的规范化与临床转化推进,未来有望为牙周组织缺损患者带来更精准、高效的治疗选择。无需复杂手术,通过局部递送工程化囊泡即可实现牙周组织的生理性再生,这不仅能让患者摆脱牙齿脱落的风险,更能减少后续修复的痛苦与经济负担,为牙周炎治疗开辟了全新路径,守护大众的口腔健康与生活品质。(生物谷Bioon.com)
参考文献:
https://doi.org/10.1016/j.bioactmat.2025.11.026
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


