Sci Transl Med:丁楅森/曹中炜/杨力明/蒲强/陈路发现m6A修饰肺血管Angiocrine靶点再生纤维化肺
来源:生物探索 2024-09-05 10:10
该研究发现了肺血管微环境中RHOJ+内皮细胞的形成机制,并揭示了在肺纤维化过程中RHOJ+内皮细胞组成的异常Pillar Cell可通过Angiocrine转变促进肺纤维化。
肺纤维化(Pulmonary fibrosis)是肺组织在慢性损伤中修复反应失调的结局,其特征是细胞外基质过度沉积和肺实质破坏,其中特发性肺纤维化 (IPF) 是最常见和普遍的肺纤维化类型【1】。由于遗传易感性和各种环境风险因素引起肺泡上皮细胞损伤、成纤维细胞增殖、成纤维细胞向肌成纤维细胞转化和病理性的细胞外基质沉积,降低肺的顺应性,导致肺功能急剧下降、呼吸困难等器官功能障碍,最终发展成为呼吸衰竭而危及生命。目前IPF的治疗尚无能够显著延长病人生存时间的药物。促进纤维化肺组织再生可望恢复受损的肺泡和血管结构,为包括肺纤维化在内的呼吸疾病治疗提供策略。因此发掘肺修复中促再生并抑制纤维化治疗靶点具有临床价值。
丁楅森和曹中炜以往工作发现血管内皮细胞通过旁分泌“Angiocrine”因子形成血管微环境与邻近细胞互作,从而调控肺的再生和纤维化【2-9】。四川大学丁楅森/曹中炜团队和哈医大杨力明、华西医院蒲强及华西二院陈路合作在Science Translational Medicine杂志(封面)发表题为Inhibiting endothelial Rhoj blocks pro-fibrotic vascular intussusception and angiocrine factors to sustain lung regeneration的研究论文,通过基因敲除小鼠、血管铸型技术、单细胞多组学、精密肺组织切片培养等手段,发现内皮细胞m6A修饰酶Methyltransferase-like 3(Mettl3)缺失后导致Rhoj+内皮细胞参与的套叠式血管生成中Pillar Cell增多,并通过调控Angiocrine因子促进肺再生向肺纤维化转变。
m6A修饰是真核生物常见的mRNA修饰,已成为一种广泛的调控机制。m6A修饰由甲基化酶和去甲基化酶动态调控,甲基化酶主要包括METTL3、METTL14和WTAP等,去甲基化酶主要包括ALKBH5和FTO等。本研究中,作者们首先构建部分肺切除模型(Pneumonectomy,PNX),筛选出在肺再生内皮细胞中显著变化的METTL3,随后利用内皮条件性敲除Mettl3(Mettl3i∆EC/i∆EC)小鼠,发现内皮细胞Mettl3缺失导致肺再生中内皮细胞异常增殖,胶原纤维异常沉积,套叠式血管异常增多。为进一步在内皮细胞中研究METTL3调控的机制,作者们采用MeRIP测序联合纳米孔三代测序技术,证明了内皮细胞METTL3通过调控FOXO1的m6A修饰,在肺再生中维持内皮细胞的促再生Angiocrine功能。
作者们进一步发现,Mettl3i∆EC/i∆EC和Foxo1∆EC/i∆EC小鼠肺再生中异常增殖的内皮细胞为Rhoj+的细胞,且有Pillar Cell特征。这群异常增殖的内皮细胞通过增强血管微环境中促纤维化的Angiocrine信号,促进血管周围成纤维细胞的活化,导致肺再生向肺纤维化转变。在肺纤维化患者和肺纤维化小鼠模型中,作者发现肺内皮细胞RHOJ的表达显著上升。而在小鼠肺内皮细胞敲低RHOJ能够抑制异常的血管生成,减少促纤维化的Angiocrine信号,减轻肺纤维化。
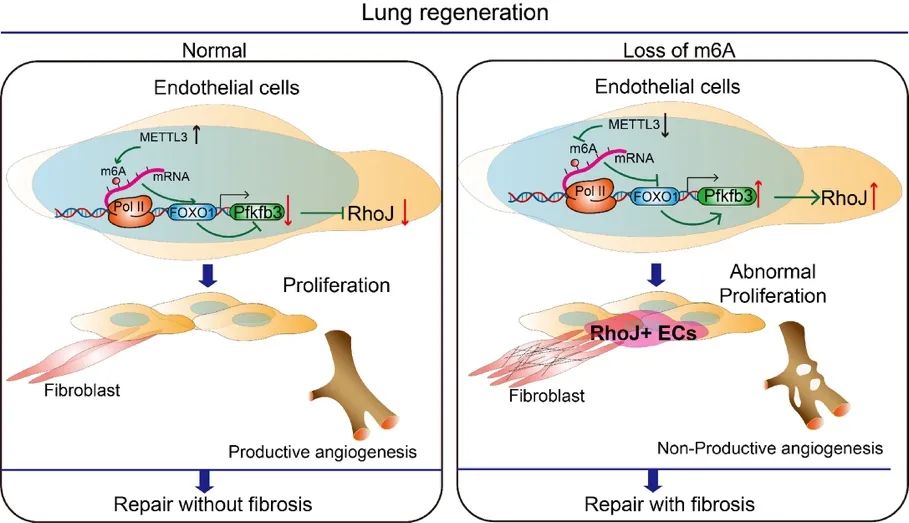
模式图(Credit: Science Translational Medicine)
总之,该研究发现了肺血管微环境中RHOJ+内皮细胞的形成机制,并揭示了在肺纤维化过程中RHOJ+内皮细胞组成的异常Pillar Cell可通过Angiocrine转变促进肺纤维化。所揭示的机制可为器官纤维化的再生疗法提供靶点,开发基于Angiocrine的药物。
参考文献:
1. King, T. E., Jr., A. Pardo and M. Selman. (2011) Idiopathic pulmonary fibrosis. Lancet 378, 1949-1961.
2. Rafii, S., Butler, J. M., and Ding, B. S. (2016) Angiocrine functions of organ-specific endothelial cells. Nature 529, 316-3252.
3. Cao, Z., Lis, R., Ginsberg, M., Chavez, D., Shido, K., Rabbany, S. Y., Fong, G. H., Sakmar, T. P., Rafii, S., and Ding, B. S. (2016) Targeting of the pulmonary capillary vascular niche promotes lung alveolar repair and ameliorates fibrosis. Nature medicine 22, 154-1623.
4. Rafii, S., Cao, Z., Lis, R., Siempos, II, Chavez, D., Shido, K., Rabbany, S. Y., and Ding, B. S. (2015) Platelet-derived SDF-1 primes the pulmonary capillary vascular niche to drive lung alveolar regeneration. Nature Cell Biology 17, 123-1364.
5. Ding, B. S., Cao, Z., Lis, R., Nolan, D. J., Guo, P., Simons, M., Penfold, M. E., Shido, K., Rabbany, S. Y., and Rafii, S. (2014) Divergent angiocrine signals from vascular niche balance liver regeneration and fibrosis. Nature 505, 97-1025.
6. Ding, B. S., Yang, D., Swendeman, S. L., Christoffersen, C., Nielsen, L. B., Friedman, S. L., and Cao, Z. (2020). Aging suppresses sphingosine-1-phosphate chaperone ApoM in circulation resulting in maladaptive organ repair. Developmental cell, 53(6), 677-690.
7. Chen, Y., Pu, Q., Ma, Y., Zhang, H., Ye, T., Zhao, C., Huang, X., Ren, Y., Qiao, L., Liu, H. M., Esmon, C. T., Ding, B. S., and Cao, Z. (2021) Aging Reprograms the Hematopoietic-Vascular Niche to Impede Regeneration and Promote Fibrosis. Cell Metabolism 33, 395-410 e394.
8. Zhang, H., Ma, Y., Cheng, X., Wu, D., Huang, X., Chen, B., and Cao, Z. (2021). Targeting epigenetically maladapted vascular niche alleviates liver fibrosis in nonalcoholic steatohepatitis. Science translational medicine, 13(614), eabd1206.
9. Mo, C., H. Li, M. Yan, S. Xu, J. Wu, J. Li, X. Yang, Y. Li, J. Yang, X. Su, J. Liu, C. Wu, Y. Wang, H. Dong, L. Chen, L. Dai, M. Zhang, Q. Pu, L. Yang, T. Ye, Z. Cao, and B. S. Ding. (2024). Dopaminylation of Endothelial Tpi1 Suppresses Ferroptotic Angiocrine Signals to Promote Lung Regeneration over Fibrosis. Cell Metabolism 36, 1839-57 e12.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


