Cell Metab丨江涛/张伟团队发现ALDH1A3别构激活PKM2通过XRCC1乳酰化修饰促进胶质母细胞瘤的放化疗抵抗
来源:生物探索 2024-08-13 12:07
该研究阐明了ALDH1A3通过别构激活PKM2,介导胶质母细胞瘤葡萄糖代谢重编程和乳酸堆积,进而通过XRCC1乳酰化修饰促进胶质母细胞瘤放化疗抵抗的分子机制。
胶质母细胞瘤是成人最常见的高度恶性颅内原发肿瘤,标准放化疗疗效不佳【1-3】。Warburg效应,即在氧气充足的条件下,糖酵解通路异常激活和乳酸积累是胶质母细胞瘤的重要代谢特征【4-5】。然而,Warburg效应如何影响胶质母细胞瘤的放化疗抵抗及临床疗效,其机制尚不明确。2024年8月6日,首都医科大学附属北京天坛医院神经外科学中心江涛院士/张伟教授团队在Cell Metabolism在线发表题为Glycometabolic reprogramming-mediated XRCC1 lactylation confers therapeutic resistance in high ALDH1A3-expressing glioblastomas的研究论文。
研究团队基于中国人群脑胶质瘤基因组图谱(Chinese Glioma Genome Atlas, CGGA)数据库证实,胶质瘤干细胞重要标志物ALDH1A3表达阳性的胶质母细胞瘤患者对标准放化疗均不敏感,并发现ALDH1A3可能通过激活肿瘤糖酵解通路促进对放化疗的抵抗。为了揭示这一现象背后的分子机制,研究团队基于前期构建的胶质瘤干细胞数据库及代谢组学分析,首次证实ALDH1A3通过与糖酵解关键酶PKM2互作激活糖酵解通路,介导肿瘤细胞内乳酸堆积,在胶质瘤干细胞中敲除ALDH1A3或特异性阻断ALDH1A3与PKM2结合可以降低糖酵解通路活性,下调肿瘤细胞内乳酸浓度。

上述研究表明,肿瘤细胞内乳酸浓度与放化疗敏感性密切相关。研究团队进一步研究发现,ALDH1A3介导的乳酸堆积主要通过上调DNA损伤修复相关蛋白XRCC1 K247位点的乳酰化修饰水平促进胶质母细胞瘤的DNA损伤修复,最终导致胶质母细胞瘤对标准放化疗的抵抗。同时,该研究开发出了针对XRCC1 K247位点乳酰化修饰的特异性抗体,可以作为临床检测工具,用于检测临床样本中XRCC1的乳酰化修饰水平。
该团队进一步通过小分子化合物高通量筛选平台,成功筛选出靶向PKM2激活位点的小分子抑制剂——D34-919,并利用胶质瘤干细胞系、小鼠原位成瘤模型以及胶质瘤类器官模型证实D34-919小分子药物可以有效阻断ALDH1A3与PKM2互作,降低肿瘤细胞内乳酸浓度及XRCC1乳酰化修饰水平,抑制DNA修复功能,提高胶质母细胞瘤对放化疗的敏感性。在动物模型中,该药物还表现出较高的血脑屏障通过率及良好的安全性,已申报国家发明专利,有望成为胶质母细胞瘤患者全新的靶向药物。
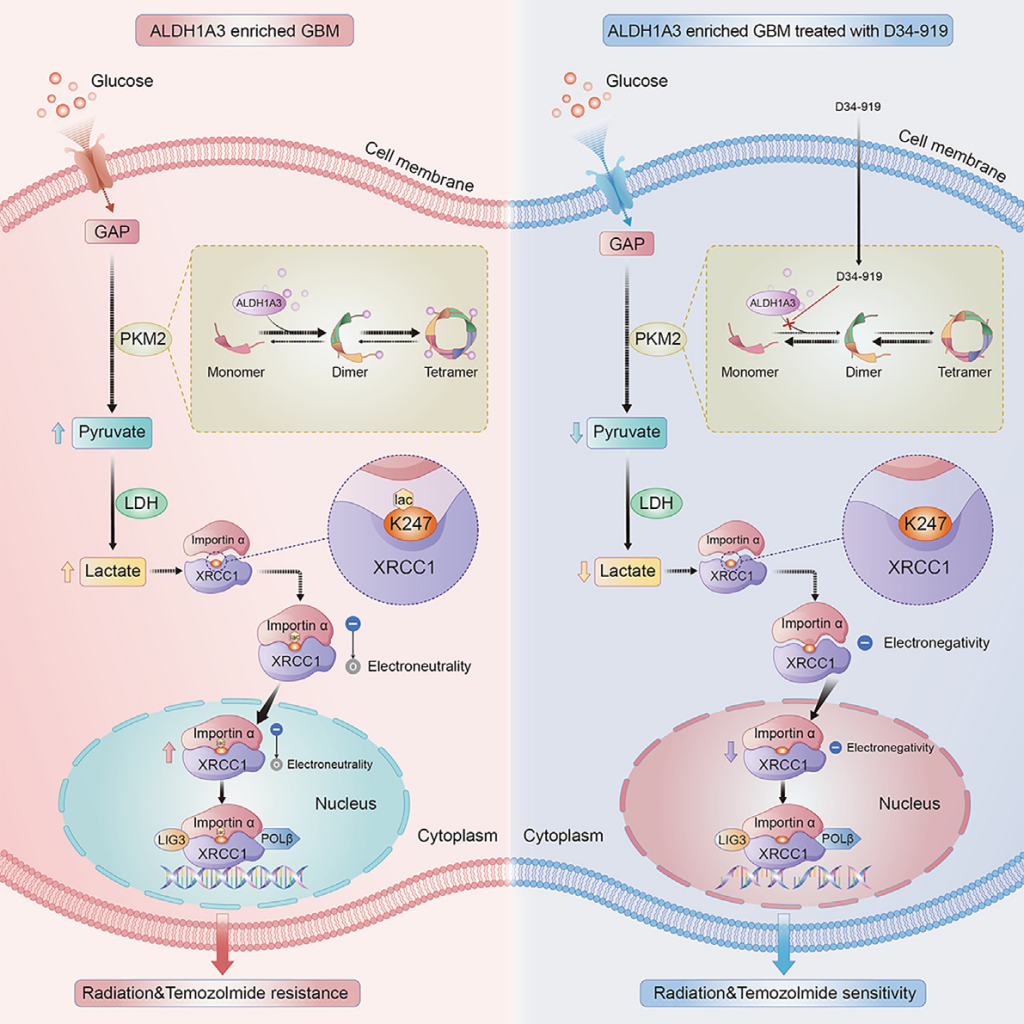
模式图(Credit: Cell Metabolism)
总之,该研究阐明了ALDH1A3通过别构激活PKM2,介导胶质母细胞瘤葡萄糖代谢重编程和乳酸堆积,进而通过XRCC1乳酰化修饰促进胶质母细胞瘤放化疗抵抗的分子机制,并开发出全新小分子靶向药物D34-919,有望改善胶质母细胞瘤患者的临床预后。
1. Louis, D.N., Perry, A., Wesseling, P., Brat, D.J., Cree, I.A., FigarellaBranger, D., Hawkins, C., Ng, H.K., Pfister, S.M., Reifenberger, G., et al. (2021). The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro Oncol. 23, 1231–1251. https://doi.org/10.1093/neuonc/noab106.
2. Ostrom, Q.T., Price, M., Neff, C., Cioffi, G., Waite, K.A., Kruchko, C., and Barnholtz-Sloan, J.S. (2022). CBTRUS Statistical Report: primary brain and other central nervous system tumors diagnosed in the United States in 2015-2019. Neuro Oncol. 24, v1–v95. https://doi.org/10.1093/neuonc/noac202.
3. Chen, W., Zheng, R., Baade, P.D., Zhang, S., Zeng, H., Bray, F., Jemal, A., Yu, X.Q., and He, J. (2016). Cancer statistics in China, 2015. CA. Cancer J. Clin. 66, 115–132. https://doi.org/10.3322/caac.21338.
4. Bi, J., Chowdhry, S., Wu, S., Zhang, W., Masui, K., & Mischel, P. S. (2020). Altered cellular metabolism in gliomas - an emerging landscape of actionable co-dependency targets. Nature reviews. Cancer, 20(1), 57–70. https://doi.org/10.1038/s41568-019-0226-5
5. Yang, W., Xia, Y., Ji, H., Zheng, Y., Liang, J., Huang, W., Gao, X., Aldape, K., & Lu, Z. (2011). Nuclear PKM2 regulates β-catenin transactivation upon EGFR activation. Nature, 480(7375), 118–122. https://doi.org/10.1038/nature10598
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


