揭示环状RNA介导的白血病抑制因子旁分泌信号的生物学报告来了!
来源:本站原创 2022-02-18 18:52
尽管多种治疗策略应用不断进步,胰腺导管腺癌(PDAC)仍然是最具侵袭性和致命的恶性肿瘤之一。
尽管多种治疗策略应用不断进步,胰腺导管腺癌(PDAC)仍然是最具侵袭性和致命的恶性肿瘤之一。癌相关成纤维细胞(CAFs)是肿瘤间质中的主要细胞类型;它们在癌症进化过程中表现出可塑性,并在PDAC中具有肿瘤促进、肿瘤抑制或稳态功能。因此,为了精确地靶向促进癌症进展的异质性CAFs,有必要加强对肿瘤微环境(TME)中CAFs调节的理解。
图片来源: https://doi.org/10.1186/s12943-022-01501-3
近日,广东省人民医院的研究人员在Molecular Cancer杂志上发表了题为“circFARP1 enables cancer-associated fibroblasts to promote
gemcitabine resistance in pancreatic cancer via the LIF/STAT3 axis《CircFARP1通过LIF/STAT3轴促进肿瘤相关成纤维细胞对吉西他滨的耐药性》”的研究文章,该研究发现,circFARP1在CAFs中的过表达促进了PDAC 吉西他滨耐药,其机制是通过增强白血病抑制因子(LIF)在CAFs中的表达和分泌,从而诱导胰腺细胞中的STAT3信号通路。这些发现为有选择性地靶向CAF亚群或介导PDAC中吉西他滨耐药的特定信号通路提供了新见解。
首先,研究者利用环状RNA测序和实时荧光定量PCR (qRT PCR)技术筛选CAF特异性环状RNA,随后研究了CAF circFARP1表达对体外和体内肿瘤细胞吉西他滨耐药的影响。最后研究者利用RNA-seq(RNA测序)、RNA
pulldown(RNA拖拽)、RNA免疫沉淀和荧光素酶报告基因检测来筛选circFARP1的下游靶点和潜在机制。
研究者发现沉默或过表达circFARP1可以改变CAFs通过白血病抑制因子LIF诱导肿瘤细胞干细胞和吉西他滨耐药的能力。
在机制上,作者发现circFARP1直接与小窝蛋白1(CAV1)结合,并阻断CAV1与E3泛素蛋白连接酶锌和环指1 (ZNRF1)的相互作用,抑制CAV1的降解,从而增强LIF的分泌。此外,circFARP1还通过海绵吸附miR-660-3p上调LIF的表达,并且,高circFARP1水平与PDAC患者血清LIF水平升高和患者生存差呈正相关。
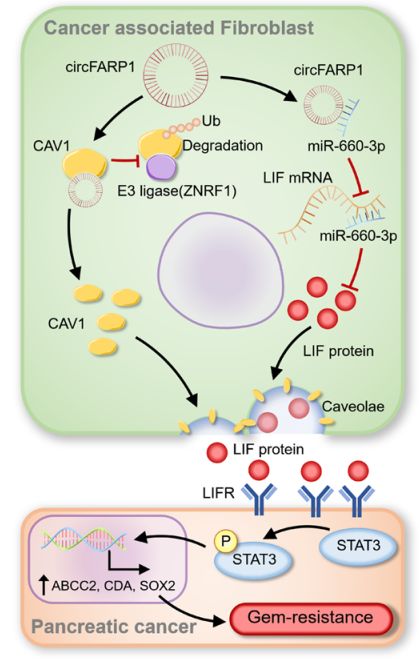
CircFARP1使CAFs促进胰腺癌GEM化疗耐药机制示意图
图片来源: https://doi.org/10.1186/s12943-022-01501-3
综上所述,该研究证明了 circFARP1在CAF中高表达,其在肿瘤组织中的丰富与晚期PDAC患者中吉西他滨耐药和低生存率呈正相关。这是首个揭示环状RNA介导的LIF旁分泌信号的生物学报告,CAFs建立了一个独特的成纤维细胞生态位,介导PDAC中的吉西他滨抗性。此外,研究者还提示,目前迫切需要制定针对TME中circFARP1/CAV1/miR-660-3p/LIF轴的合理策略,以克服胰腺癌患者的GEM耐药。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



