《自然·通讯》:仁济医院团队揭示“癌王”肝转移的关键分子机制
来源:奇点糕 2023-03-10 16:21
总之,这项研究通过解释SLIT2-ROBO1轴在PMN及MMN形成中的重要作用及调控机制,系统阐述了胰腺癌肝转移过程中肿瘤细胞和肝脏细胞共适应的分子机制,为胰腺癌肝转移开发了治疗新靶点及新策略。
胰腺癌是最致命的恶性肿瘤之一,最主要的治疗方式仍为根治性切除联合化疗的综合治疗,然而将近80%的患者由于已并发远处转移而无法行手术切除,尤其以肝转移最为常见[1]。因此,揭示胰腺癌肝转移的分子机制,对于改善胰腺癌预后,延长生存具有重要意义。
在肿瘤转移过程中,源自于原发肿瘤的播散性肿瘤细胞(DTC)和靶器官微环境存在共适应现象,即“种子与土壤”的相互适应[2,3]。因此,破译胰腺癌播散性细胞和肝脏微环境中正常细胞相互适应的关键事件,对于阐明胰腺癌肝转移的分子机制至关重要。
转移前生态位(PMN)和转移后生态位(MMN)的形成是肿瘤转移的关键事件[4]。研究表明,PMN形成是肿瘤转移的第一步,且PMN形成会诱导靶器官中的正常细胞募集形成复杂肿瘤微环境(TME)所需的细胞,以更好的形成“土壤”[5,6]。因此,解析PMN及MMN形成的机制对于解决胰腺癌肝转移具有重要指导意义。
近日,由上海交通大学张志刚、李军和孙勇伟领衔的研究团队在《自然·通讯》杂志发表了一项重要研究成果。这项研究发现,肿瘤表面表达的依赖性受体ROBO1与肝细胞来源的配体SLIT2之间相互作用,促进了DTC与肝脏细胞的相互适应,进而导致胰腺癌肝转移;且靶向ROBO1的中和性抗体可阻断这种共适应效应从而抑制胰腺癌肝转移[7]。
总之,这项研究破译了胰腺癌肝转移过程中肿瘤细胞与肝脏细胞相互适应的机制,为胰腺癌肝转移提供了一种新型治疗策略。
文章封面截图
为模拟胰腺癌肝转移的PMN及MMN的形成,张志刚团队通过脾内注射KPC1199和Panc02细胞系,构建了正常肝脏、PMN(KPC1199注射后7-11天,Panc02注射后5-8天)和MMN模型(KPC1199注射后5-8天,Panc02注射后第9天),并使用小动物CT、生物发光及组织染色等技术证明构建模型的可靠性。
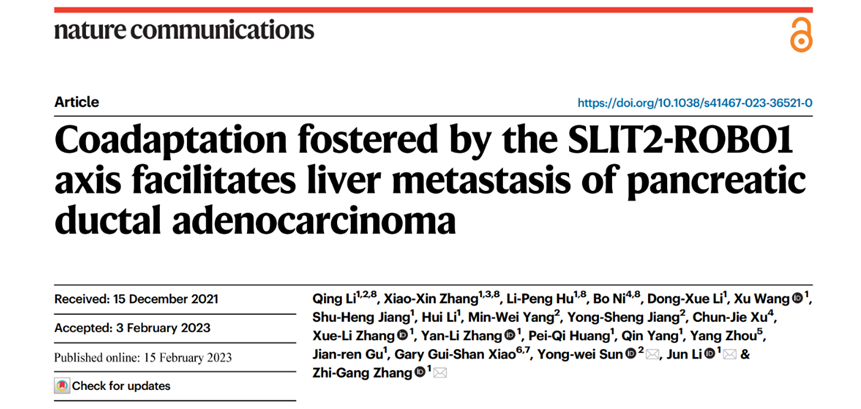
为揭示胰腺癌肝转移过程中共适应现象的机制,他们使用转录组学检测了正常肝脏、PMN及MMN阶段肝脏细胞中差异表达的基因。结果发现,相比于正常肝脏,PMN及MMN阶段的肝脏细胞出现更明显的轴突引导途径改变,并发现SEMA3e、SLIT2 和 EFNA4三个基因在PMM及MMN中均明显上调(图1)。
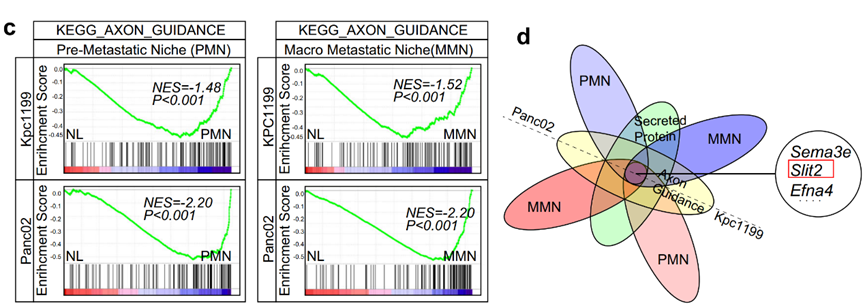
图1. 正常肝脏、PMN及MMN阶段肝脏细胞中的差异基因
进一步的研究结果表明,SLIT2在PMN形成过程中开始出现,并持续表达到MMN阶段完成,且通过对胰腺癌肝转移患者的样本进行染色发现,SLIT2来源于肝脏细胞而不是肿瘤细胞。
也就是说,SLIT2是“土壤”中的关键配体。但要介导“土壤与种子”的共适应效应,还需要肿瘤细胞中的配体。
环形引导家族(ROBO)成员是SLIT2的主要受体[8]。在这里,张志刚团队发现,仅有ROBO1在转移性胰腺癌细胞中表达(图2e),且在肝脏转移的组织中ROBO1与SLIT2之间具有很强的相关性(图2h),存在直接相互作用。
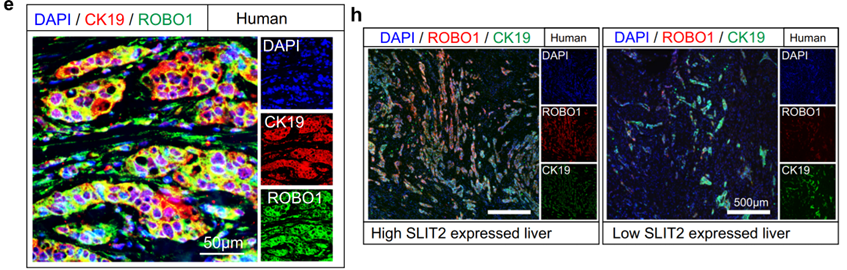
图2. 肿瘤细胞中ROBO1是SLIT2的受体
为明确SILT2及ROBO1在胰腺癌肝转移中的作用,他们构建了SLIT2敲除鼠,并通过慢病毒注射恢复SLIT2在肝细胞中的表达,随后向脾脏中注射表达ROBO1的肿瘤细胞。
结果表明,SLIT2的缺失可显著抑制胰腺癌肝转移中PMN及MMN的形成,而SLIT2恢复后这种效果出现了逆转(图3)。
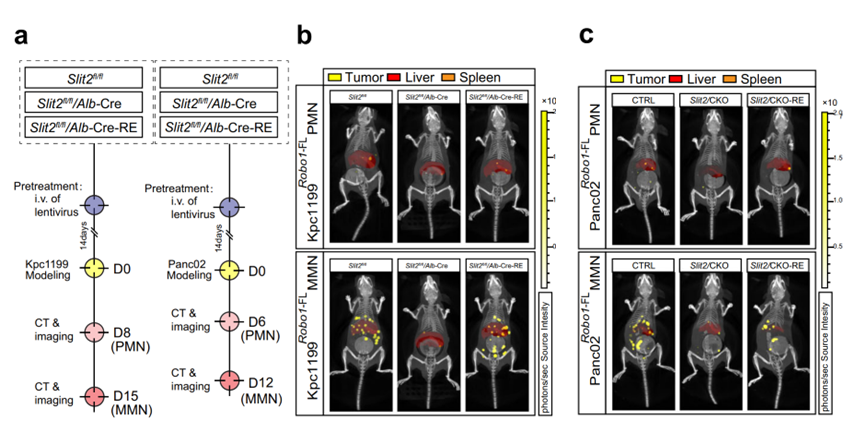
图3. SLIT2在胰腺癌肝转移PMN和MMN形成中的作用
他们还发现,给予ROBO1中和性抗体后,可显著降低胰腺癌肝转移鼠中的PMM及MMN的形成(图4)。此外,表达ROBO1的肿瘤细胞和表达SLIT2的肝细胞可以出现协同适应现象,肿瘤微环境中SLIT2的缺失或者ROBO1的阻断,可削弱ROBO1阳性的肿瘤细胞在肝脏微环境中的竞争优势。
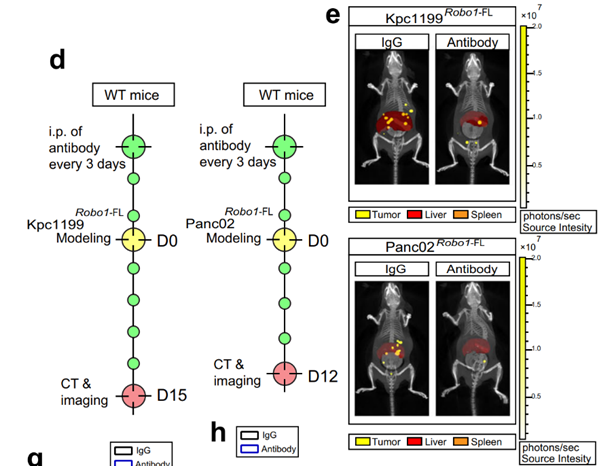
图4. ROBO1抗体对胰腺癌肝转移的抑制作用
不仅如此,张志刚团队还构建了野生型及Ig结构域缺失(ΔROBO1,删除ROBO1与SLIT2互作的片段)的ROBO1过表达肿瘤细胞系,并注射入小鼠脾脏。
结果发现,过表达野生型ROBO1后可显著上调PMM及MMN形成,而过表达ΔROBO1时却无此种现象(图5)。这说明,ROBO1对胰腺癌肝转移的作用依赖于与SLIT2的相互作用。
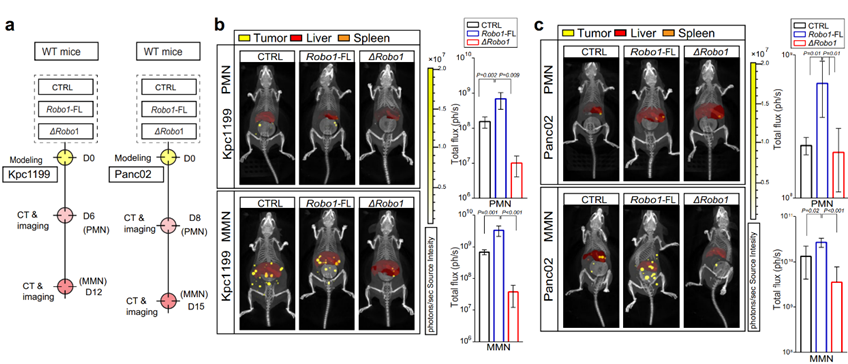
图5. ROBO1-SLIT2的相互作用在胰腺癌肝转移中的重要作用
由于丝裂原活化蛋白激酶(MAPK)通路在肿瘤增殖、转移过程中发挥了重要作用,张志刚团队假设ROBO1可通过激活MAPK通路促进胰腺癌肝转移。
结果确实如此。他们发现,SLIT2与ROBO1的结合显著提高了p38α MAPK的磷酸化;而使用ROBO1中和性抗体时,p38α MAPK磷酸化水平则显著降低(图8)。具体来看,ROBO1直接与p38α MAPK和MEK3/6结合,而SLIT2的结合进一步增强了p38α MAPK的磷酸化水平。
简而言之,从机制上来看,SLIT2与ROBO1复合体可以增加p38α MAPK与其激酶MEK3/6相互作用进而激活下游MAPK通路,促进胰腺癌肝转移。
总之,这项研究通过解释SLIT2-ROBO1轴在PMN及MMN形成中的重要作用及调控机制,系统阐述了胰腺癌肝转移过程中肿瘤细胞和肝脏细胞共适应的分子机制,为胰腺癌肝转移开发了治疗新靶点及新策略。
参考文献
[1] Houg DS, Bijlsma MF. The hepatic pre-metastatic niche in pancreatic ductal adenocarcinoma. Mol Cancer. 2018 Jun 14;17(1):95. doi: 10.1186/s12943-018-0842-9.
[2] Curtis M, Kenny HA, Ashcroft B, et al. Fibroblasts Mobilize Tumor Cell Glycogen to Promote Proliferation and Metastasis. Cell Metab. 2019 Jan 8;29(1):141-155.e9. doi: 10.1016/j.cmet.2018.08.007.
[3] Zhang L, Zhang S, Yao J, et al. Microenvironment-induced PTEN loss by exosomal microRNA primes brain metastasis outgrowth. Nature. 2015 Nov 5;527(7576):100-104. doi: 10.1038/nature15376.
[4] Peinado H, Zhang H, Matei IR, et al. Pre-metastatic niches: organ-specific homes for metastases. Nat Rev Cancer. 2017 May;17(5):302-317. doi: 10.1038/nrc.2017.6.
[5] Erler JT, Bennewith KL, Cox TR,et al. Hypoxia-induced lysyl oxidase is a critical mediator of bone marrow cell recruitment to form the premetastatic niche. Cancer Cell. 2009 Jan 6;15(1):35-44. doi: 10.1016/j.ccr.2008.11.012.
[6] Lee W, Ko SY, Mohamed MS, et al. Neutrophils facilitate ovarian cancer premetastatic niche formation in the omentum. J Exp Med. 2019 Jan 7;216(1):176-194. doi: 10.1084/jem.20181170.
[7] Li Q, Zhang XX, Hu LP, et al. Coadaptation fostered by the SLIT2-ROBO1 axis facilitates liver metastasis of pancreatic ductal adenocarcinoma. Nat Commun. 2023 Feb 15;14(1):861. doi: 10.1038/s41467-023-36521-0.
[8] Yadav SS, Narayan G. Role of ROBO4 signalling in developmental and pathological angiogenesis. Biomed Res Int. 2014;2014:683025. doi: 10.1155/2014/683025.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


