剑桥大学团队用“温度计”测到驱动痴呆症的关键蛋白会让细胞“燃烧”
来源:中国生物技术网 2022-06-13 10:07
该团队表示,这是首次在活细胞中发现Aβ42蛋白的伸长直接导致细胞平均温度升高的现象。 随后的一项实验中,研究人员向细胞添加一种小分子化合物MJ040,阻止了Aβ42的聚集,并避免了细胞温度升高。
近30年的普遍观点认为,大脑中存在的β淀粉样蛋白(Aβ)和过度磷酸化Tau蛋白组成的神经原纤维缠结驱动了阿尔兹海默症。虽然Aβ肽的大小不同,但以残基42结尾的肽是最丰富的。少量Aβ42的沉积物也会随着年龄的增长而形成,并且可能与病情有关。
然而,阿尔兹海默研究领域可谓是困难重重,到目前为止最大的问题是,科学家们仍无法完全理解导致Aβ在大脑中形成的原因。
近日,发表在《美国化学学会杂志(JACS)》上的一项新研究中,来自剑桥大学领导的研究团队发现,随着阿尔兹海默症的病情发展可能导致大脑细胞严重过热。生热效应与细胞应激有关,而后者可能促进了Aβ42的聚集。该团队将细胞经历的这一过程描述为“像煎蛋一样”,从而破坏了细胞功能。

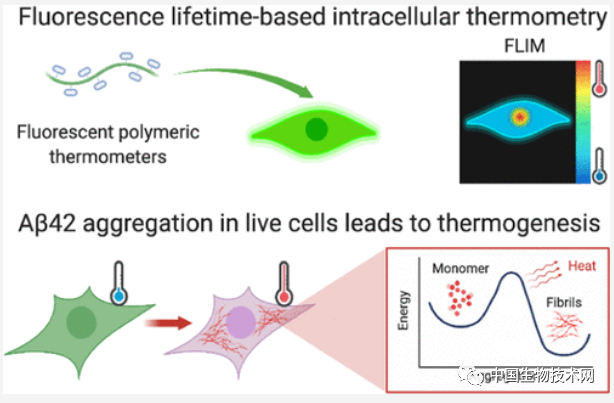
在实验中,研究人员在人类细胞系中添加淀粉样β淀粉样蛋白(Aβ42)以触发聚集过程。一旦Aβ42开始形成原纤维的细线,细胞的平均温度就开始升高,然后它们会以生热的形式释放能量。通过抑制Aβ42蛋白在其他细胞中的聚集,研究人员确定了原纤维的形成是细胞生热的原因。

由于Aβ42蛋白聚集需要大量的能量才能进行,一旦聚集过程开始,就会加速并释放更多热量,从而形成更多的聚集物。
研究第一作者、剑桥大学化学工程与生物技术系化学工程师Chyi Wei Chung说:“一旦聚集物形成,它们就会离开细胞并被邻近的细胞吸收,从而感染这些细胞中健康的β淀粉样蛋白。”
随后的一项实验中,研究人员向细胞添加一种小分子化合物MJ040,阻止了Aβ42的聚集,并避免了细胞温度升高。
研究人员表示,因为MJ040是Aβ42伸长的有效抑制剂,它可以在疾病的后期给药,从而通过减少Aβ42伸长诱导的生热来阻止进一步的成核过程。
鉴于上述发现,该团队提出,未来的阿尔茨海默症治疗可以将防止β淀粉样蛋白的聚集视为保持大脑细胞冷却和存活一种至关重要的方法。
研究人员表示,基于这项研究成果的治疗方法还有很长的路要走,但这项研究澄清了围绕该疾病的一个谜团。科学家们曾认为,细胞变热可能是由线粒体损伤导致的。
Chung说:“生热与细胞应激有关,这可能促进β淀粉样蛋白的进一步聚集。我们认为,当细胞中存在不平衡时,例如当淀粉样蛋白浓度略高并开始聚集时,细胞温度也会随之升高。”
除了实验外,研究人员还使用计算机模型来评估β淀粉样蛋白如何在细胞内作用以提高温度,这有助于科学家更全面地了解这种影响数千万生命的疾病。
通过上述模型,研究人员希望激发这一领域的进一步工作,以开发更准确描述复杂细胞内现象的方法。这些现象会导致生物细胞内温度升高,而这可能意味着神经退行性变。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


