王泽峰团队综述mRNA疗法的进展和挑战
来源:生物世界 2023-11-27 09:32
LNP除肝脏外的器官递送可以通过修改脂质组成来实现,其中包括调整脂质特性和/或脂质比例。LNP成分可以显著影响细胞内递送效率,决定递送的细胞特异性,并调节免疫原性。
中国科学院上海营养与健康研究所RNA系统生物学研究组王泽峰研究员和魏欢欢副研究员受邀在国家自然科学基金委主办期刊《基础研究》(Fundamental Research)“RNA生物学与治疗”专题发表了题为:mRNA therapeutics: New vaccination and beyond 的综述,探讨了mRNA疗法的最新进展,展示了其在疫苗研究以及其他领域的潜在应用,并着重介绍了新一代环形mRNA技术,提供了预防性疫苗以外的mRNA疗法的概述和展望。

在与疾病的斗争中,人类倾向于向生命本身学习,并利用自然界提供的一切。从次级代谢物到大分子,从细胞到器官,这些生命成分都可以被设计并应用于新的医学治疗。作为关键的大分子之一,信使RNA(mRNA)也有潜力被应用于新的治疗方法。mRNA疗法的概念很简单,它使用体外转录的mRNA来指导体内具有药理活性的蛋白质的翻译。mRNA理论上几乎可以产生任何功能性蛋白/多肽用于疫苗接种或蛋白替代疗法。
然而,自从mRNA编码药物的概念被构想出来以来,研究人员花费了几十年的时间和巨大的努力才最终成功地生产出商业产品。
COVID-19大流行期间,两款新冠mRNA疫苗(BNT162b2和mRNA-1273)的紧急使用授权凸显了mRNA作为一种新型疫苗的潜力,并引领了mRNA疗法的新时代。
与基于DNA和蛋白质这两种大分子的药物相比,mRNA表现出一些非凡的优势。由于mRNA是蛋白质翻译的模板,基于mRNA的药物在许多方面压倒了蛋白质药物。具体而言,mRNA克服了外源表达蛋白质的翻译后修饰、折叠、装配和定位的障碍。同时,它可以同时为由多个亚基组成的抗原编码多个蛋白质,解决了以正确的化学计量法重建蛋白质亚基的挑战。此外,mRNA的生产和制造比蛋白质更快、更灵活、更方便,也更便宜,特别是作为在大流行期间快速筛选和开发疫苗产品的工具。另一方面,与DNA疗法相比,mRNA不需要进入细胞核才能发挥功能,因此产生插入突变的风险可以忽略不计。此外,与DNA相比,mRNA具有瞬时活性,减少了对宿主稳态构成负担的可能性。这些令人印象深刻的优势使mRNA疗法成为最新但最有前途的治疗策略,受到了研究界、资助机构和生物医学行业的极大关注。
尽管mRNA疗法已经实现了安全、可编程、灵活和具有成本效益的设计和生产,但mRNA的固有特性和其他技术限制带来了相当大的挑战。三个主要挑战是——表达的稳定性和持续性、免疫调节和体内靶向给药。这些挑战引起了研究人员的极大兴趣,并付出了巨大的努力来寻找相应的解决方案。
在这篇综述中,王泽峰团队详细介绍了基于mRNA的疗法的进展和挑战,强调了有助于将mRNA技术扩展到疫苗以外的创新和解决方案。

mRNA疗法的优势和面临的挑战
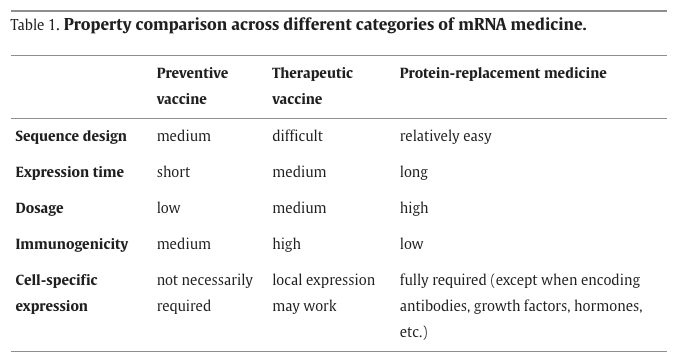
从应用领域来看,当前的mRNA疗法可大致分为三类基本类型——针对传染病的预防性疫苗、针对癌症的治疗性疫苗,以及作为直接免疫疗法或其他蛋白质药物的蛋白替代药物。
mRNA预防性疫苗的原理是将体外转录的mRNA递送到人体内,翻译出抗原蛋白,从而刺激免疫系统抵御病原体入侵。免疫系统可识别mRNA产生的抗原蛋白,通过主要组织相容性复合体I(MHC I)激活能够“杀死”感染细胞的细胞毒性T细胞(CD8+ T细胞),或通过MHC II和辅助T细胞(CD4+ T细胞)刺激B细胞产生中和抗体。
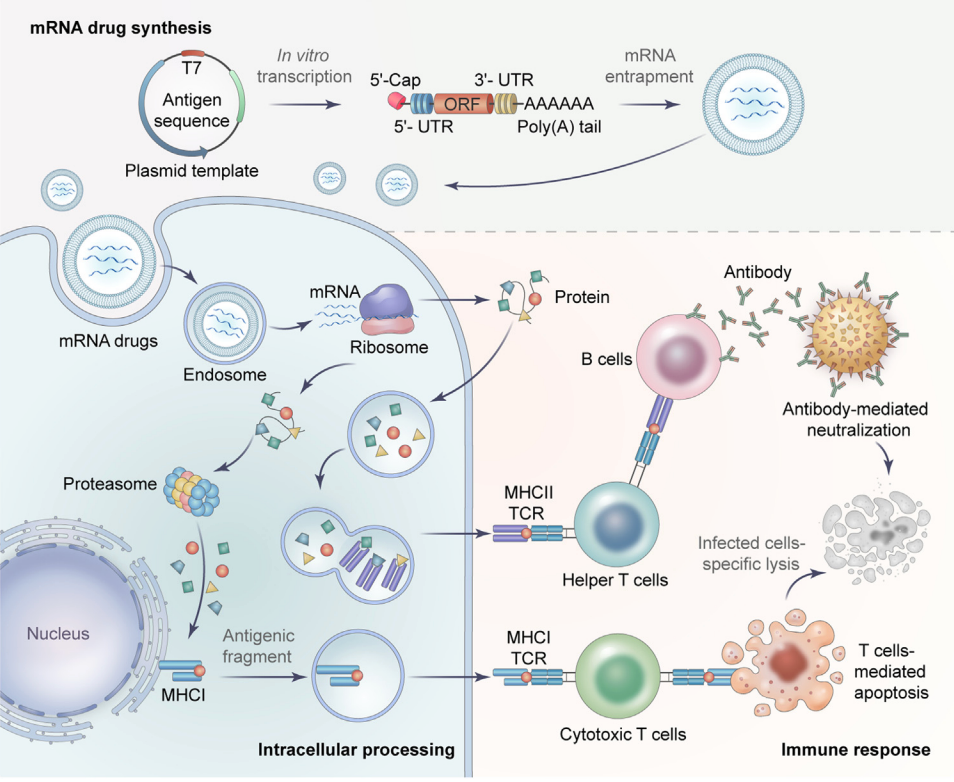
抗原编码mRNA疗法策略
随着疫苗的不断改进,最近发生了范式转变,不仅将疫苗用于疾病预防,而且还用于疾病治疗。治疗性疫苗的研究主要集中在癌症领域,不仅由于癌症的固有特点,还因为最近在癌症免疫治疗领域的爆发和成功,包括免疫检查点阻断(ICB)、嵌合抗原受体T细胞(CAR-T)介导的治疗,以及肿瘤特异性抗原。癌症治疗性疫苗的关键思路是使用肿瘤特异性抗原来训练人体免疫系统,从而高特异性杀死癌细胞。由于mRNA与DNA疫苗相比具有更高的免疫原性,能够编码多种抗原或具有多种表位的完整抗原,以及快速制造的能力,似乎具有巨大的潜力作为治疗性疫苗,特别是作为癌症疫苗来启动和放大抗癌免疫反应。
对于癌症疫苗,即使抗原可以诱导细胞免疫反应,抑制性的肿瘤微环境也可能阻止T细胞浸润到肿瘤中,导致T细胞耗竭。因此,治疗性癌症疫苗可能需要与其他疗法(例如免疫检查点抑制剂)相结合,以获得更好的疗效。总的来说,由于肿瘤免疫的复杂性,治疗性癌症疫苗的成功开发相当具有挑战性,在抗原选择和临床试验设计方面都需要进一步优化。
虽然每种mRNA疗法都有其独特的挑战,但所有mRNA疗法都面临一些共同的挑战。第一个挑战是提高mRNA表达的稳定性和持续时间。由于mRNA易被降解,导致RNA产品(特别是长RNA)的生产、储存和运输成本较高。此外,治疗性疫苗和蛋白替代疗法需要细胞中mRNA药物的长表达时间,这可以通过提高mRNA的稳定性来实现。
第二个挑战是RNA的高固有免疫原性。外源性和配制的mRNA被各种固有免疫反应识别时具有免疫刺激作用。在蛋白替代疗法的应用中,由于翻译抑制和细胞毒性,固有免疫系统的激活是不希望发生的。Katalin Karikó 和 Drew Weissman 等人通过假尿苷修饰等方法来抑制RNA的免疫原性并促进蛋白质翻译,从而解决了这一问题。这项技术为mRNA的治疗应用做出了至关重要的贡献。然而,这种核苷修饰相对昂贵,并在序列设计中增加了额外限制。
第三个挑战是mRNA的体内递送。mRNA需要进入细胞质才能翻译产生功能蛋白,但由于mRNA体积较大且带电,难以穿过细胞膜的阴离子磷脂双分子层,限制了mRNA在体内表达目标蛋白。为了获得安全有效的mRNA细胞内递送,许多递送系统得到了证实,其中脂质纳米颗粒(LNP)表现出了应用潜力。但LNP的配方仍有很大的改进空间,特别是mRNA的治疗性疫苗和蛋白替代应用需要细胞或组织特异性递送,迫切需要进一步开发合理的递送系统。
在mRNA治疗的关键步骤中,包括序列设计、mRNA合成和生产以及靶向给药,都面临着巨大挑战。此外,研究人员已经突破了线性mRNA药物的限制,开发了环形RNA(circRNA)作为mRNA疗法的替代模式,其能够长期表达,求具有低免疫原性。它还提供了巨大的治疗潜力,特别是在mRNA预防疫苗之外的蛋白替代疗法中。
circRNA是共价闭合的单链RNA(ssRNA)分子,主要由pre-mRNA通过反式剪接产生。大多数circRNA源于编码蛋白质的基因,并包含完整的外显子。此外,含有外显子的circRNA主要定位于细胞质。总的来说,circRNA虽然被归类于非编码基因,但其具有作为mRNA指导蛋白质表达的潜力,相关研究也证实了外源性circRNA可以在体内翻译蛋白。一些研究题也表明,内源性circRNA同样可以翻译蛋白。
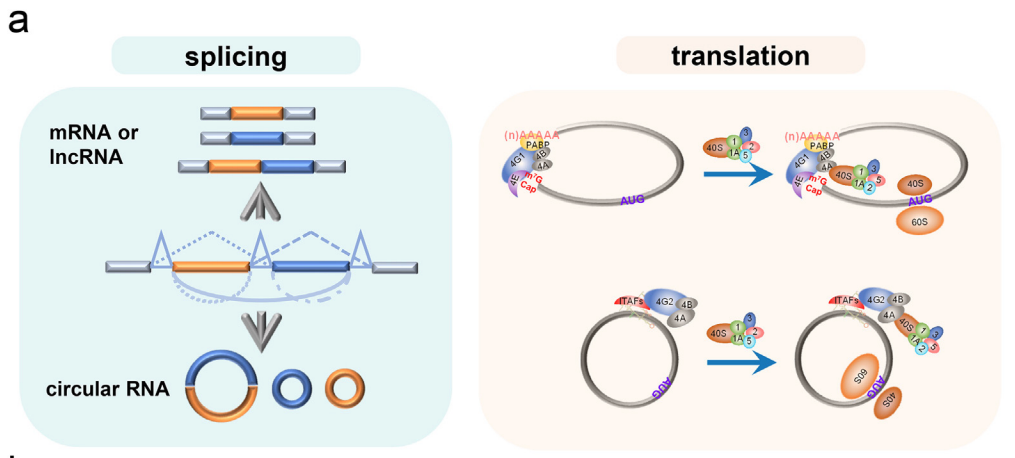
circRNA的剪接与翻译
circRNA分子的几个特点使其成为新一代mRNA药物的有吸引力的候选者,特别是作为蛋白替代疗法。首先,circRNA比其同源线性mRNA具有更高的细胞稳定性,可能是因为它们在体外对核酸外切酶的降解具有抵抗性,并且/或在体内对免疫诱导的线性RNA衰变机制具有抵抗性。circRNA的第二个优势是,与线性RNA相比,纯化的circRNA具有较低的免疫原性,这对于长期表达非常重要。
circRNA应用的一个主要挑战是体外大规模生产。体外合成circRNA的常用方法可分为两类:RNA连接酶介导的直接连接和核酶介导的自剪接。使用T4 RNA连接酶直接将线性前体RNA环化是多年前开发的经典方法。这种方法可以生成无外源片段的circRNA,其免疫原性最小。然而,其通常需要辅助的夹板(splint)序列来完成环化。这种方法难以规模化生产。此外,连接酶的使用将增加产品纯化的复杂性,因此这种策略主要用于实验室研究。
circRNA也可以通过引入自催化的I类内含子来产生,这些内含子起环化酶核酶的作用。这种优化的在真核生物中设计高效稳定的circRNA翻译的方法被称为PIE(置换内含子-外显子),已被进一步用于生产预防SARS-CoV-2的circRNA疫苗。但这种方法会在circRNA序列中留下了一个外来片段作为“疤痕”序列,这可能会扭曲circRNA的结构,引发先天免,从而限制其作为蛋白替代疗法的应用。科锐迈德的研究团队开发了一种名为Clean-PIE的方法,以生产免疫原性最小化的无疤痕circRNA。此外,王泽峰团队开发了一种名为CirCode的新方法,使用自剪接II类内含子,以共转录的方式高效产生免疫原性低的无疤痕circRNA,且可以扩展到大规模生产。由此产生的circRNA非常稳定,可以延长在不同细胞中蛋白质翻译的时间。
circRNA的生产不需要5′端帽子和碱基修饰步骤,从而显著降低了生产的复杂性和成本。但作为一种新疗法,circRNA仍然存在独特的技术障碍,包括高效环化和翻译的序列设计,以及高效的体内递送。
为了改善药理特性,mRNA的序列设计和合成在mRNA治疗中至关重要。所有五个功能区域,包括5′端帽子、5′-UTR、编码区(CDR)、3′-UT和poly(A)尾巴,都必须仔细设计,以实现高效的蛋白质翻译。
circRNA的设计应集中在三个区域:自催化内含子、IRES和ORF。一般来说,circRNA的ORF设计被认为与线性mRNA相似,但无需碱基修饰。IRES是设计的重点,因为它们不仅影响circRNA翻译效率,而且还具有通过结合组织特异性IRES反式作用因子(ITAF)来调节组织特异性表达的潜力。经典的IRES主要来自病毒序列,并在circRNA模式中用于驱动翻译。然而,最近的研究表明,许多其他序列可以作为IRES类元件或调控元件来促进IRES活性和刺激翻译。因此,筛选和优化宿主友好型和组织特异性的IRES对circRNA技术至关重要。此外,自催化内含子被发现显著影响循环效率,因此筛选和优化高度活化的自催化内含子也可能有助于circRNA药物。
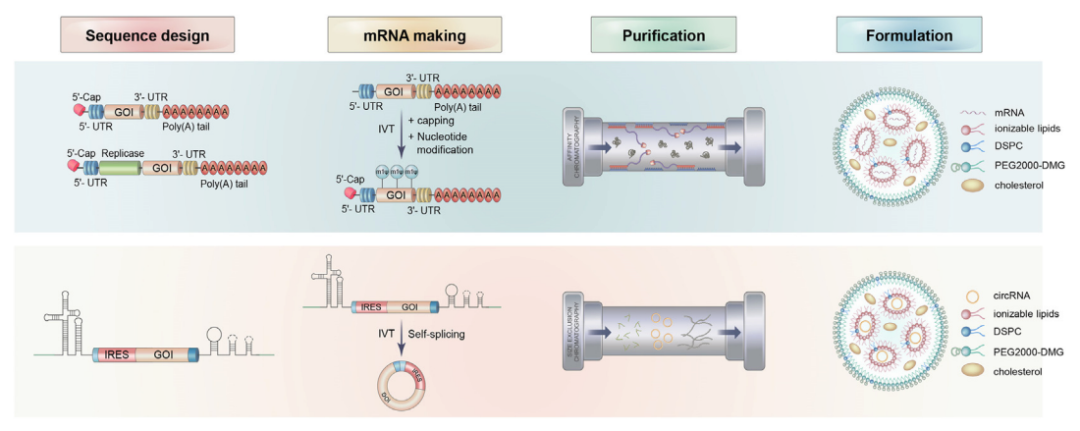
线性mRNA与circRNA药物在生产流程中的比较
大分子RNA的体内靶向递送是近几十年来mRNA疗法领域的一个重大挑战。其中,脂质纳米颗粒(LNP)是目前唯一被批准用于临床的新冠mRNA疫苗的递送系统,也是目前mRNA递送最广泛使用的方法,而其他许多递送方法则处于实验室研究和临床研究的阶段。
通常,LNP由四种成分组成,包括可离子化脂质、胆固醇、辅助磷脂和聚乙二醇(PEG)-脂质。这四种成分可以形成稳定的纳米颗粒,以封装和保护易降解的mRNA。纳米颗粒通过内吞作用进入细胞,并在内吞体的酸性环境中带正电荷,促进随后的mRNA释放到细胞质中。然而,LNP制备的mRNA倾向于在肝脏中积累,可能是因为载脂蛋(ApoE)与LNP结合,然后由ApoE受体介导摄取到肝细胞。大多数LNP-mRNA药物在静脉注射给药后集中在肝脏和脾脏中,少量在脂肪组织中。在肌内注射的情况下,mRNA药物的表达主要见于肝脏、肌肉和淋巴结。
此外,LNP除肝脏外的器官递送可以通过修改脂质组成来实现,其中包括调整脂质特性和/或脂质比例。LNP成分可以显著影响细胞内递送效率,决定递送的细胞特异性,并调节免疫原性。例如,在LNP中添加SORT脂质改变了LNP在体内的器官靶向性,实现了mRNA向其他器官和组织的递送。此外,还可以通过调整LNP组分的化学计量来实现靶向递送。还有研究显示,通过对合成脂质纳米颗粒库的体内筛选,简单改变LNP的头部结构,mRNA可以被导向不同的肺部亚细胞类型。
自20世纪90年代概念验证以来,mRNA疗法经历了漫长的发展路径,先后克服了几个主要的技术困难,包括稳定性差、先天免疫和递送问题。而新冠大流行的压力在最终将这一新技术变成现实方面发挥了至关重要的作用,这反过来为这种新药物模式的其他应用铺平了道路。尽管取得了早期成功,但该领域仍存在许多技术挑战,目前正在进行深入研究。新的RNA平台技术,包括circRNA和saRNA,以及新的递送方法的发展,可能会将mRNA疗法扩展到新的前沿,例如细胞的体内编程。此外,为mRNA疗法开发的方法可能会对未来的RNA药物,包括长链非编码RNA(lncRNA)疗法,有所帮助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


