JEM:刘庆淮/肖明团队发现,Aβ的脑-眼转运导致阿尔茨海默病视网膜病变
来源:生物世界 2024-10-03 10:15
为了进一步探究视网膜Aβ来源,研究团队对小鼠进行小脑延髓池立体定位注射荧光标记的hAβ示踪剂,发现hAβ示踪剂在视神经和视网膜中的分布显示出时间依赖性,并与血管密切相关。
南京医科大学刘庆淮/肖明团队在 Journal of Experimental Medicine 期刊发表了题为:Transport of β-amyloid from Brain to Eye Causes Retinal Degeneration in Alzheimer’s Disease 的研究论文。
该研究揭示了Aβ的脑-眼转运导致了阿尔茨海默视网膜病变,并提出了脑-眼转运的三种方式,这可能是眼科和神经退行性疾病中全新的治疗靶点。

首先,研究团队使用Aβ抗体6E10对阿尔茨海默病(AD)捐献者和AD基因鼠5×FAD小鼠眼部组织进行免疫染色,发现Aβ沉积增多,且主要集中在视网膜和视神经的血管周围间隙,并在眶周淋巴管中沉积。且10月龄的5×FAD小鼠表现出明显的视网膜退行性改变。
Aβ由淀粉样前体蛋白(APP)经β-分泌酶和γ-分泌酶切割产生,PS1是γ-分泌酶的关键组分。研究团队发现,5×FAD小鼠模型中,APP和PS1在脑中的表达显著增加,但在视网膜中未见差异,表明视网膜中的Aβ积累不是由于原位生成增加。
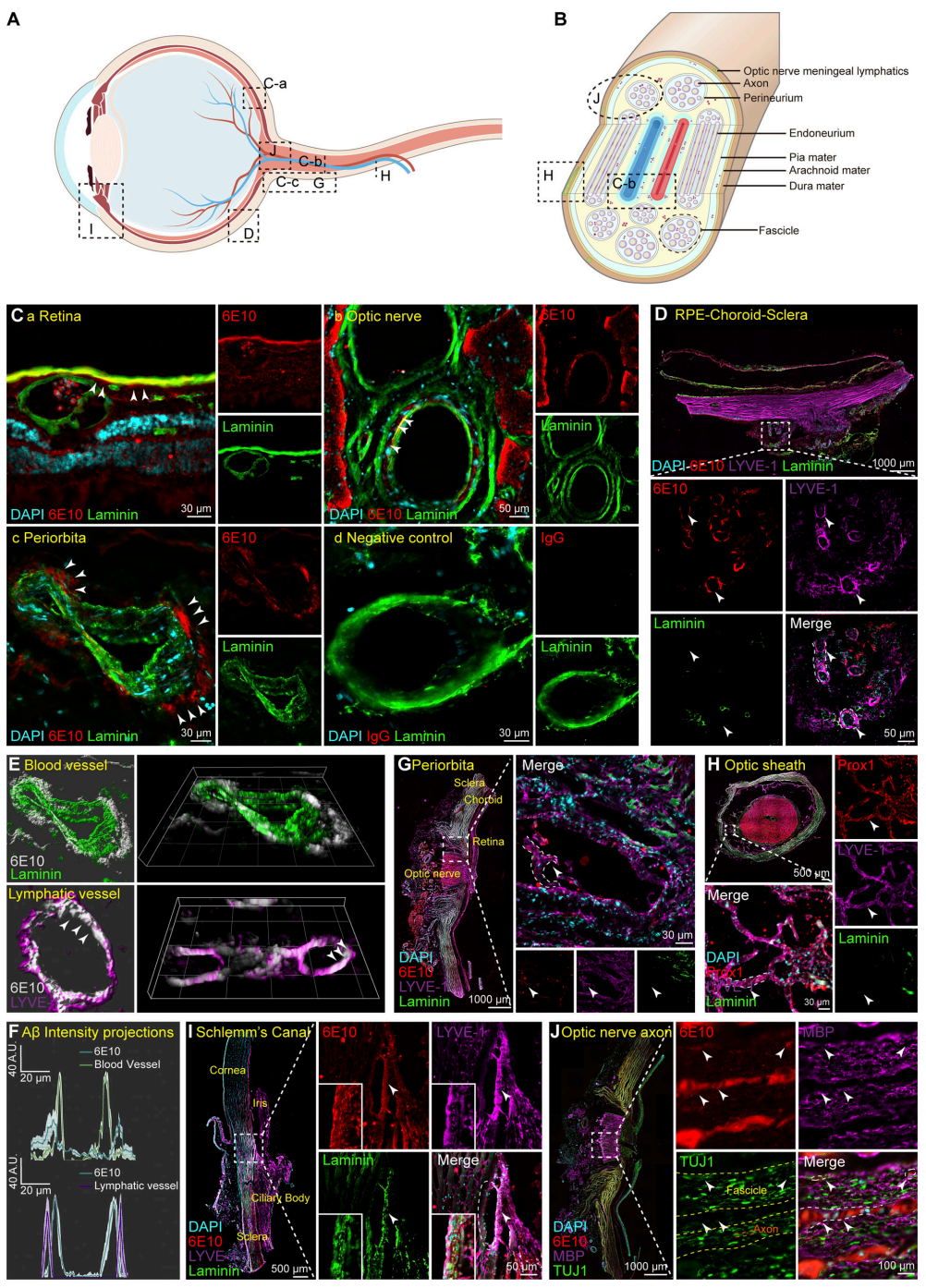
AD患者视网膜及视神经Aβ沉积情况
为了进一步探究视网膜Aβ来源,研究团队对小鼠进行小脑延髓池立体定位注射荧光标记的hAβ示踪剂,发现hAβ示踪剂在视神经和视网膜中的分布显示出时间依赖性,并与血管密切相关。脑源性hAβ在视神经鞘扩散,并通过血管旁间隙和视神经轴突到达视网膜。此外,视神经鞘膜淋巴管和眶周淋巴管也参与了脑源性hAβ的清除。这些结果揭示了从脑到眼的Aβ转运途径。
该团队前期研究表明,脑类淋巴系统的毒性代谢物运输依赖于水通道蛋白4(AQP4)的极性。由于眼部类淋巴系统与脑类淋巴系统在细胞和分子结构上类似,研究团队推测AQP4可能介导了Aβ从脑到眼的转运。小鼠视网膜的单细胞测序结果和免疫荧光实验显示,Aqp4主要在视网膜的胶质细胞中表达,主要集中在血管周围。
使用AQP4基因敲除(KO)小鼠,发现AQP4的缺失减缓了hAβ从脑到眼的转运速率。扩展了hAβ示踪实验的时间窗厚,显示眼部Aβ沿着视网膜、视神经血管周围间隙,通过眶周淋巴管视神经鞘膜淋巴管排出到外周淋巴结。这表明,眼类淋巴系统-视神经鞘膜淋巴管途径可能在清除视网膜Aβ中发挥关键作用。
关于脑到眼的Aβ转运导致阿尔茨海默病视网膜病变的具体机制,研究团队分别对野生型和AQP4 KO小鼠进行hAβ1-42寡聚体注射,并在注射后持续观察hAβ的荧光强度。结果表明,AQP4缺失或极性破坏会延缓Aβ从脑到眼的转运,阻碍长期清除,并加剧视网膜退行性病变。
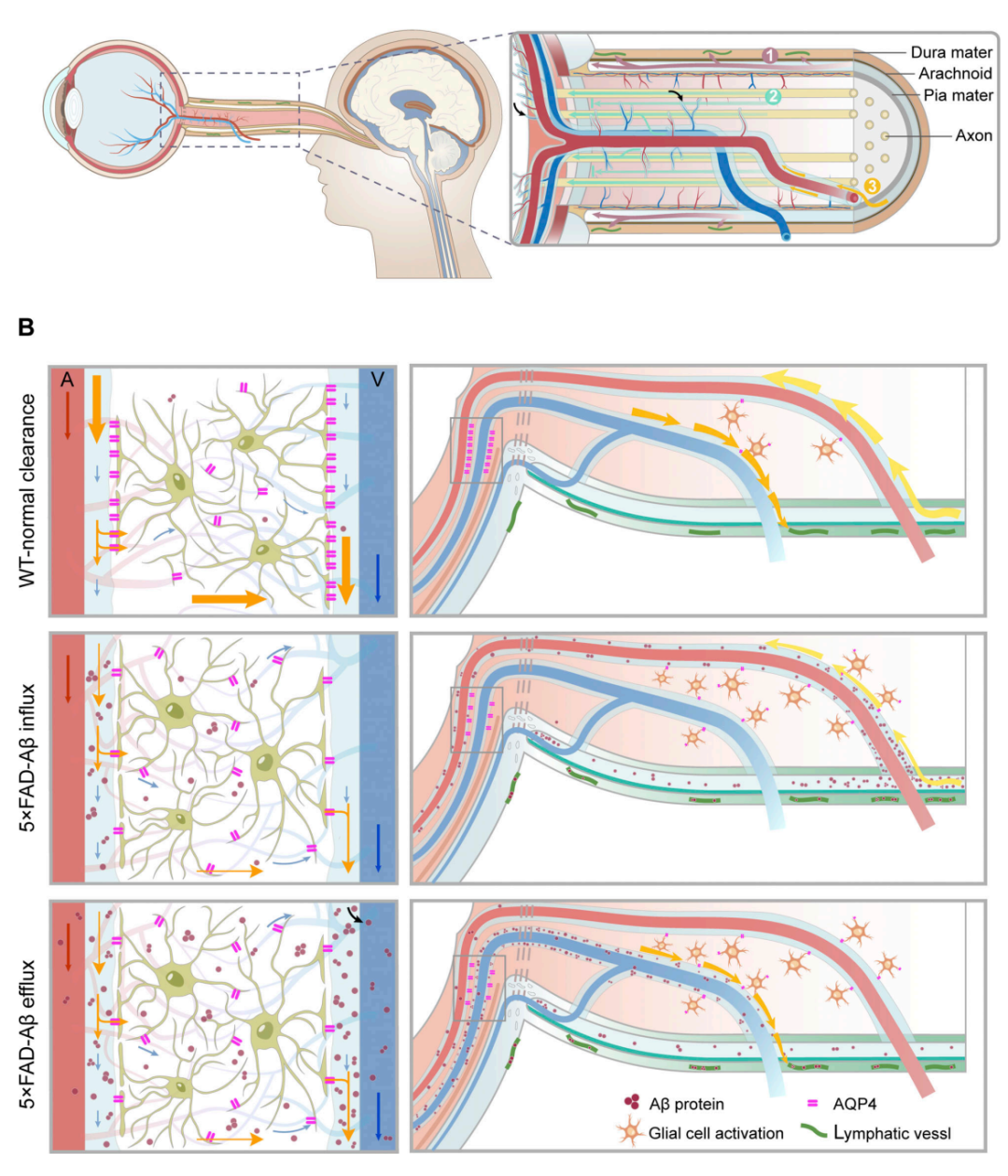
该研究提出两个创新的理论:
1、脑脊液中的Aβ可由视神经鞘膜-淋巴途径、轴突间隙途径、动脉周围间隙途径三条脑眼通路转运至眼;
2、可通过调控AQP4影响脑眼转运及视网膜类淋巴清除系统及AD眼部病理改变。
这两个理论不仅解释了阿尔茨海默病(AD)进程中眼部Aβ从何而来,到何处去,以及引发怎样的病理改变,而且通过脑眼结合的角度为眼科、神经科的退行性病变探索新的发病机制及治疗靶点,脑眼结合的交叉研究对脑病及眼病具有重要的临床意义!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


