登上Cell子刊:正大天晴BET抑制剂临床试验结果发布,安全有效治疗复发或难治性淋巴瘤
来源:生物世界 2025-11-01 14:17
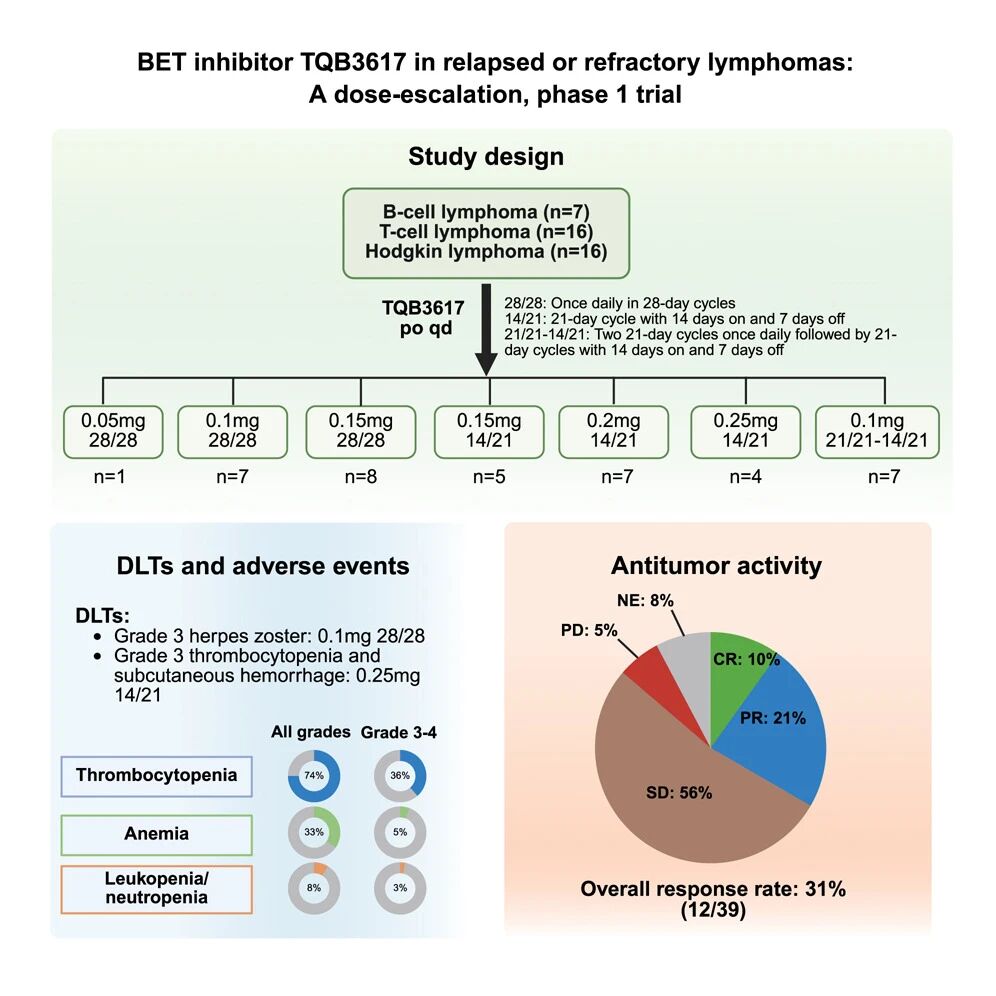
这项多中心 1 期临床试验结果显示,口服 BET 抑制剂 TQB3617 在复发或难治性淋巴瘤患者中表现出可接受的安全性和良好的疗效,最常见的治疗相关不良事件为血小板减少症,发生率为 36%。
ET 蛋白失调会导致组蛋白异常乙酰化,从而在恶性肿瘤中引发 c-Myc、NF-κB 等致癌基因表达。TQB3617 是正大天晴开发的一种口服 BET 抑制剂,能竞争性结合 BET 蛋白并抑制其活性。
2025 年 10 月 27 日,中山大学肿瘤防治中心蔡清清、夏奕,首都医科大学北京同仁医院王亮等在 Cell 子刊 Med 上发表了题为:TQB3617, a bromodomain and extra-terminal inhibitor, in patients with relapsed or refractory lymphoma: A multicenter, phase 1 trial 的临床研究论文。
这项多中心 1 期临床试验结果显示,口服 BET 抑制剂 TQB3617 在复发或难治性淋巴瘤患者中表现出可接受的安全性和良好的疗效,最常见的治疗相关不良事件为血小板减少症,发生率为 36%,客观缓解率为 31%(12/39,其中 4 名患者完全缓解),这项试验还确定了推荐的 2 期临床试验剂量。

这项 1 期临床试验评估了 TQB3617 在复发或难治性淋巴瘤患者中的安全性、药代动力学和疗效。主要终点为安全性、剂量限制性毒性(DLT)以及推荐的 2 期临床剂量(RP2D)。次要终点包括药代动力学和疗效。
这项 1 期临床试验采用 3+3 剂量递增设计,共纳入 39 名患者,每天一次接受口服 TQB3617(0.05 至 0.25 毫克剂量)治疗。在 0.1 毫克剂量组中,有 1 名患者出现 3 级带状疱疹;在 0.25 毫克剂量组中,有 1 名患者出现 3 级血小板减少症和皮下出血。安全监测委员会选定了 0.1 毫克剂量,每天一次,在两个 21 天周期后,后续周期为 14 天用药,7 天停药,作为推荐的 2 期临床试验剂量。最常见的 3-4 级治疗相关不良事件(TRAE)是血小板减少症(14/39,36%)。3 名患者因治疗相关不良事件(均为血小板减少症)而停止研究治疗。
客观缓解率(ORR)为 31%(12/39;其中 4 例完全缓解),其中,霍奇金淋巴瘤患者的 ORR 为 31%(5/16),T 细胞淋巴瘤患者的 ORR 为 31%(5/16),B 细胞淋巴瘤患者的 ORR 为 29%(2/7)。
该研究的亮点:
TQB3617 在淋巴瘤患者中的推荐 2 期剂量得到确认;
TQB3617 具有可接受的安全性,血小板减少症是主要的毒性反应;
TQB3617 展现出良好的抗肿瘤疗效,客观缓解率为 31%。
总的来说,这项 1 期临床试验结果表明,TQB3617 在复发或难治性淋巴瘤患者中显示出可接受的安全性和良好的疗效。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


