《科学》子刊:KI团队开发的乳腺癌筛查模型,不错过20倍隐匿风险的高危人群
来源:奇点糕 2022-06-22 10:02
如果拍摄数字乳腺断层融合X线成像(Digital Breast Tomosynthesis,DBT),就可以筛查出妇女患乳腺癌的风险并且有针对性的给出健康指导,你会相信吗?
如果拍摄数字乳腺断层融合X线成像(Digital Breast Tomosynthesis,DBT),就可以筛查出妇女患乳腺癌的风险并且有针对性的给出健康指导,你会相信吗?
其实AI已来!
乳腺癌一直是女性癌症死亡的最常见原因[1]。随着乳房X光检查的普及,女性乳腺癌死亡率降低了25%到40%[2,3]。然而,并不是所有的乳腺癌都能通过乳房X光检查确诊。
在筛查中,相当大比例的乳腺癌被遗漏或掩盖[4],大约40%的患者在确诊时已到达晚期[5]。一些筛查结果为阴性或良性的乳腺癌,如果在一年之内再次筛查时被确诊,则称为间歇期癌症(interval cancers),这种“漏网之鱼”往往生长和扩散更快[6],与预后较差、乳腺癌相关死亡率增加相关[7]。
目前,筛查的间隔时间和年龄范围都是乳腺癌筛查的重点争论对象,而乳腺癌的风险因素也有待更多探索[8]。
因此,瑞典卡罗林斯卡学院团队基于DBT图像,开发用于预测妇女患乳腺癌风险的模型,主要是针对那些获得阴性或良性筛查结果、但仍有可能在下一次筛查前或筛查时出现乳腺癌的女性,进行临床护理和保健工作[9]。
他们发现,在乳房X光检查后一年内用来预测乳腺癌患病风险时,DBT模型展现出良好的性能(AUC为0.82),敏感度比现有风险预测模型高1.5-2.4倍。
同时,他们利用DBT模型发现,有14%的女性在阴性或良性筛查后,仍具有乳腺癌患病高风险,在筛查后的一年内患病风险比普通人群高出近20倍。
文章于近期发表在《科学·转化医学》期刊上。
论文首页截图
在此之前,该团队已经基于多个二维(2D)乳房X光成像特征和年龄,来预测在常规筛查之前或下一次常规筛查时乳腺癌诊断的风险[10]。
但本次模型使用的DBT图像可以一次性最多生成300张图像,能够展现更多细节,远远超过2D乳房X光检查获得的4张图像。因此,本研究也是目前全球首次构建的包含由DBT采集产生的附加图像数据的模型。
本次研究共纳入来自美国的805名乳腺癌女性患者和5173名健康女性,她们于2014年至2019年期间进行过DBT筛查,从DBT筛查到乳腺癌诊断的中位随访时间为371天(四分位数范围:366至415天)。参与研究的人群特征如下:
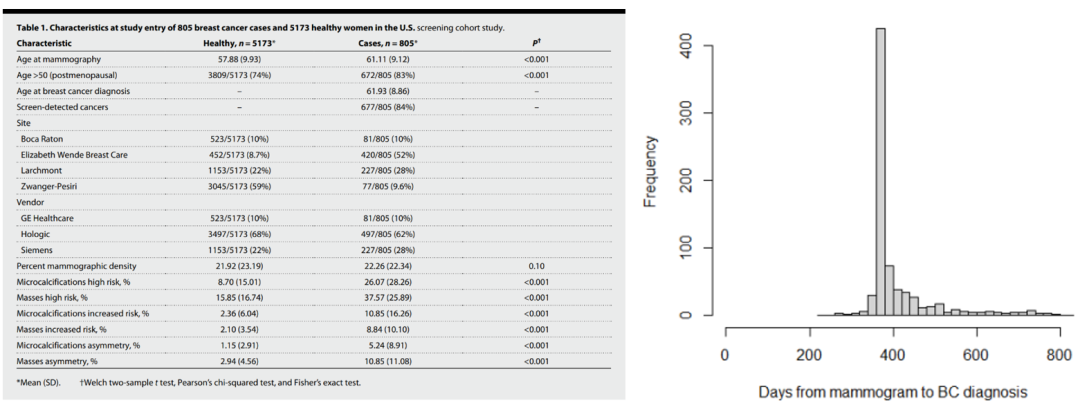
左:纳入研究人群特征;右:从DBT筛查到乳腺癌诊断的中位风险随访时间
研究团队在调整年龄因素后,使用弹性网络Logistic回归和嵌套交叉验证来建立风险模型。该模型基于乳房X光检查结果(乳房密度、微钙化、肿块),及其左右乳房上的差异、年龄差异,对乳房中多个亚区进行评估,通过分数来量化乳腺癌风险。
结果显示,该DBT模型的性能良好,用于在筛查后1年内预测乳腺癌患病风险时,AUC值达到0.82(95%CI,0.79~0.85)。
具体来看,在评估浸润性癌和原位癌风险时,DBT模型的AUC值分别为0.82(95%CI,0.79~0.86)和0.81(95%CI,0.76~0.86)。在评估乳房低密度和高密度(低于和高于人群中位数)时,AUC值分别为0.82(95%CI,0.77~0.86)和0.82(95%CI,0.78~0.86)。对筛查发现的癌症和间歇性癌症进行评估时,DBT模型的AUC值分别为0.83(95%CI,0.80~0.86)和0.80(95%CI,0.71~0.88)。
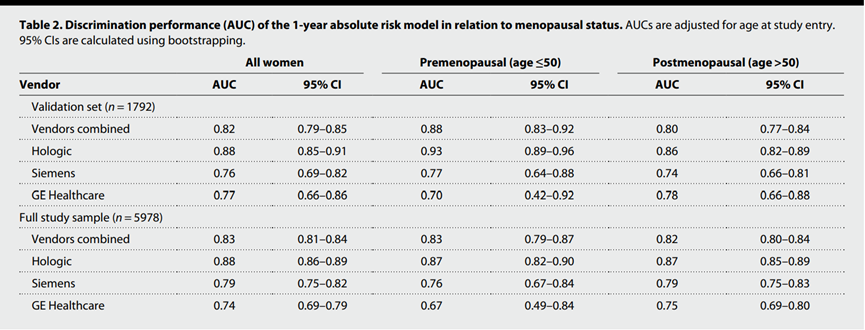
对于不同年龄(绝经前后)的乳腺癌患者来说,DBT模型预测性能良好
既然性能有了保障,研究者们便用DBT模型揭示了不同危险因素与乳腺癌风险的关系。
研究表明,乳房的整体乳房 X 线摄影密度与乳腺癌高风险相关,优势比(OR)为1.23 (95%CI, 1.03~1.47)。
对于肿块,单个高危分区和多个高危分区与乳腺癌高危相关,OR值分别为2.25(95%CI,1.2 4~4.11)和3.93(95%CI,1.39~25.33)。不过,肿块的左右乳房差异与低风险相关,OR值为0.04(95%CI,0.0 1~0.133)。
相比之下,对于微钙化,风险最高的单个亚区以及微钙化的左右乳房差异与乳腺癌高风险相关,OR值分别为1.56(95%CI,0.78~3.12)和4.54(95%CI,0.67~24.87),而风险增加的多个区域与较低的风险相关,OR为0.18(95%CI,0.04~1.06)。
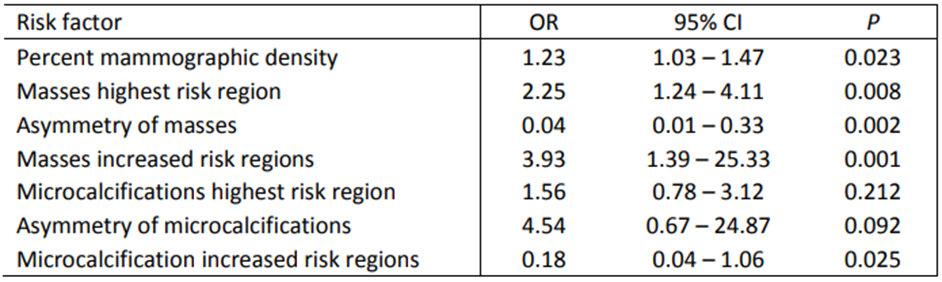
乳房 X 线照相特征的相对风险
值得注意的是,根据美国预防服务工作组USPSTF的指南[11],研究者们基于该DBT模型指出,14%的女性在阴性或良性筛查后仍具有乳腺癌患病高风险,她们在筛查后的一年内患病风险比普通人群高出19.6倍。这些高危人群在后期诊断时,76%的人处于乳腺癌II/III期,59%的人处于乳腺癌0期,58%的人处于乳腺癌I期。
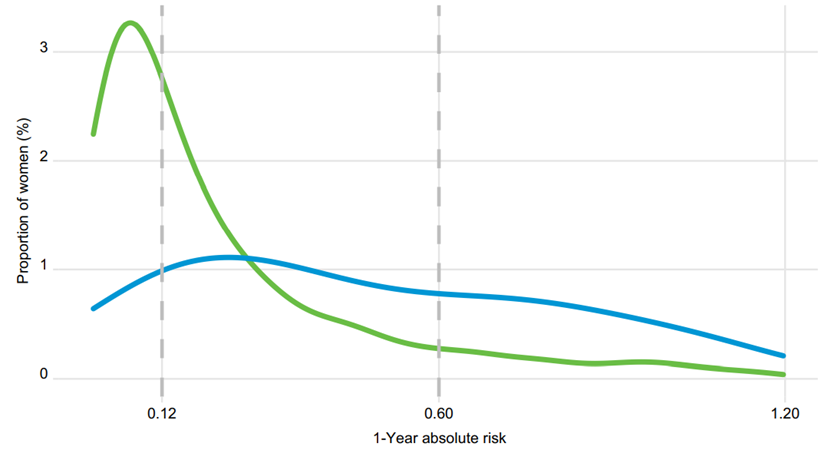
筛查后1年内,乳腺癌绝对风险的频率分布。
(蓝色:验证数据集中的乳腺癌组;绿色:健康女性)
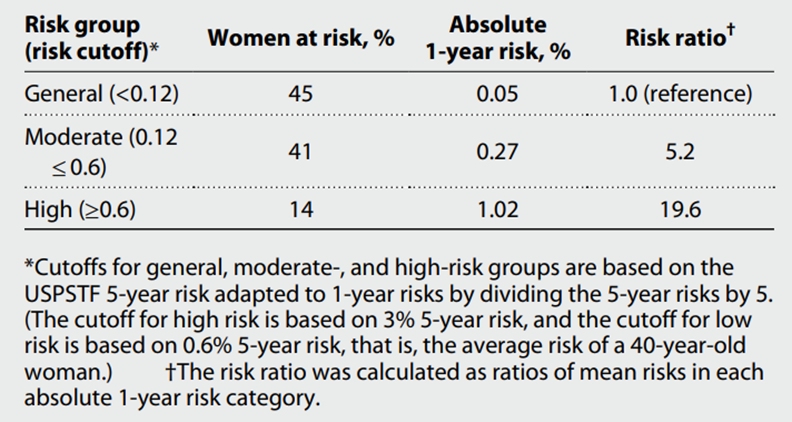
乳腺癌发生的1年绝对风险的风险分类。1年平均风险为0.28%。分析中的数据集是对基础筛查人群中的女性进行反向概率加权。验证集为154200名女性中的30%,即46260人。
不仅如此,研究团队还将此次的DBT模型,与之前报道的两种风险模型(全场数字乳房X光检查FFDM模型、基于生活方式-家族史和乳房X光检查密度模型 )进行了比较。
结果显示,从AUC值上看,DBT风险模型更胜一筹,FFDM风险模型的AUC值为0.73,生活方式-家庭风险模型的AUC值为0.62。这三种模型的ROC曲线见下图A到C,在高风险女性中的癌症累积收益见下图D。敏感度方面,与FFDM和生活方式-家族风险模型相比,DBT风险模型的敏感度分别高1.5倍和2.4倍。
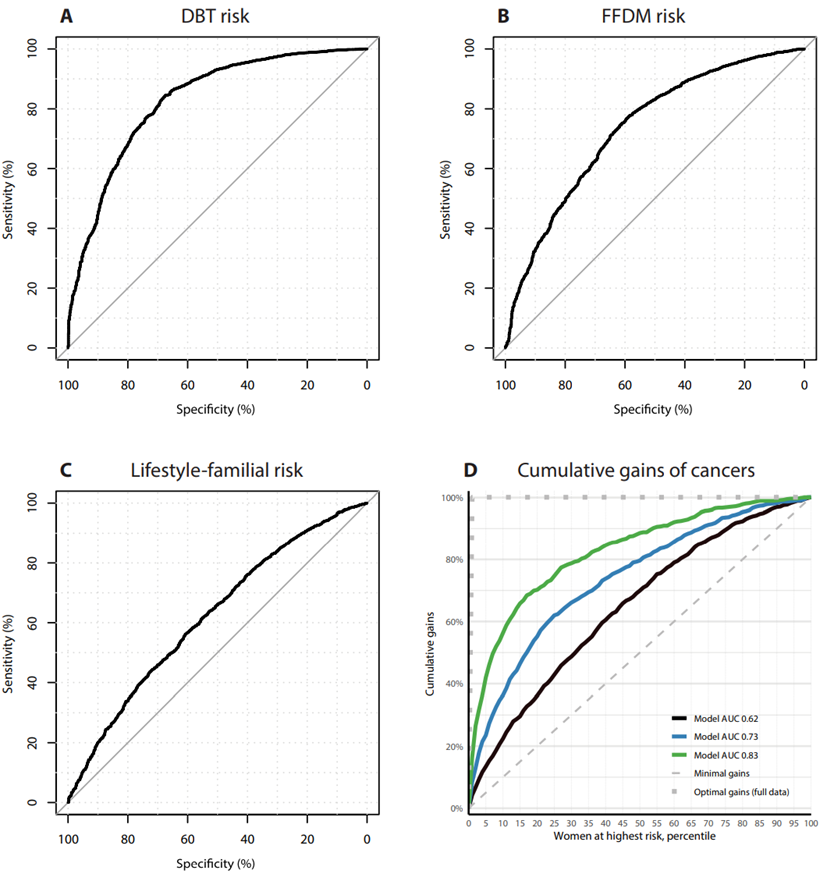
三种模拟风险模型的ROC和与乳腺癌风险最高的女性相关的癌症收益
总体来说,瑞典卡罗林斯卡学院团队基于DBT图像开发了一项乳腺癌风险预测模型,性能良好,能够识别筛查结果为阴性或良性、但仍有可能在下一次筛查前或筛查时出现乳腺癌的女性。
本研究也有一定缺陷,主要表现在以下几点:1)研究数据的局限性,只覆盖了35-74岁,虽然这是接受筛查的普遍年龄,但仍需要扩大年龄范围来进一步调查。2)DBT门架仅限于GE Healthcare、霍洛奇和西门子这三家供应商,其他供应商数据还需要进一步的验证。3)对风险模型的模拟比较,应该通过对外部独立数据的分析来验证,此次无法评估按种族背景分层的歧视性和风险分层表现。4)本研究是基于有限的数据集,独立的研究样本来自与训练集相同的来源人群,对独立和筛选代表性来源人群的研究还需要进一步验证。5)需要一项干预性研究来确定在风险辅助筛查计划的早期阶段可以识别和治疗的癌症的比例。
当然,瑕不掩瑜。针对乳腺癌的影像组学验证模型研究并不少见,但本研究构建的风险预测模型,首次使用DBT图像,并联合分析三种乳房X光检查特征、左右乳房差异和年龄。在不久的将来,它或许能够帮助放射科医生,更好地识别可能从额外或增强筛查中受益的女性,为改善乳腺癌筛查和早期风险评估提供了新策略。
值得一提的是,2017年时,在一篇刊登于Nature期刊封面的文章中,斯坦福大学领衔的拍图识病开启了医学人工智能的热潮。随后几年内,基于临床图像、病理图像、CT等影像的医学辅助诊疗神经网络算法,在皮肤疾病、癌症预测等领域飞速发展。这项研究中的DBT风险模型,作为深度卷积神经网络在乳腺癌中的应用,再次让我们看到了医学人工智能的无限潜力。
AI已来的时代,你觉得医疗AI会改变你的生活吗?会带来更加健康的世界吗?
参考文献:
1.C. Harding, F. Pompei, D. Burmistrov, et al. Breast cancer screening, incidence, and mortality across U.S. counties. JAMA Intern. Med. 175, 1483–1489 (2015).
2. B. Lauby-Secretan, C. Scoccianti, D. Loomis, et al. Breast-cancer screening—Viewpoint of the IARC Working Group. N. Engl. J. Med. 372, 2353–2358 (2015).
3. L. Tabar, T. H. Chen, A. M. Yen, et al. Early detection of breast cancer rectifies inequality of breast cancer outcomes. J. Med. Screen. 28, 34–38 (2021).
4.V. D. V. Sankatsing, J. Fracheboud, L. de Munck, et al. National Evaluation Team for Breast cancer screening, NETB, Detection and interval cancer rates during the transition from screen-film to digital mammography in population-based screening. BMC Cancer 18, 256 (2018).
5.C. Duggan, D. Trapani, A. M. Ilbawi, et al. National health system characteristics, breast cancer stage at diagnosis, and breast cancer mortality: A population-based analysis. Lancet Oncol. 22, 1632–1642 (2021).
6.N. Houssami, K. Hunter, The epidemiology, radiology and biological characteristics of interval breast cancers in population mammography screening. NPJ Breast Cancer 3, 12 (2017).
7.J. Holm, J. Li, H. Darabi, et al. 1112 associations of breast cancer risk prediction tools with tumor characteristics and metastasis: Analysis of polygenic risk score, mammographic density and Tyrer-Cuzick predicted 10-year breast cancer risk. Eur. J. Cancer 3, S167–S168 (2015).
8.N. Dimitrova, Z. S. Parkinson, A. Bramesfeld, et al. The European Breast Guidelines (Joint Research Centre (JRC), 2016).
9.M. Eriksson, S. Destounis, K. Czene, et al. A risk model for digital breast tomosynthesis to predict breast cancer and guide clinical care. SCIENCE TRANSLATIONAL MEDICINE. 14, eabn3971 (2022).
10.M. Eriksson, K. Czene, Y. Pawitan, et al. A clinical model for identifying the short-term risk of breast cancer. Breast Cancer Res. 19, 29 (2017).
11.A. L. Siu; U.S. Preventive Services Task Force, Screening for breast cancer: U.S. Preventive Services Task Force recommendation statement. Ann. Intern. Med. 164, 279–296 (2016).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


