沈阳药科大学最新Cell子刊论文:铁死亡+免疫治疗,双管齐下抗肿瘤
来源:生物世界 2025-11-11 11:34
该研究为通过缓解实体瘤缺氧微环境以增强铁死亡的抗肿瘤免疫疗法开辟了一个充满希望的方向。
近年来,铁死亡(ferroptosis)作为一种有前景的抗肿瘤疗法崭露头角。它主要是由细胞膜中多不饱和脂肪酸的氧化所驱动,导致脂质过氧化、膜破坏,最终导致细胞死亡。除了直接杀伤肿瘤细胞外,铁死亡通常还伴随着损伤相关分子模式(DAMP)的释放。这些 DAMP 可用作免疫原性分子模式,诱导树突状细胞(DC)成熟,从而进一步有效增强 T 细胞活化。
迄今为止,已经开发出了几种典型的铁死亡诱导策略,包括增加肿瘤细胞内的铁离子含量、减少谷胱甘肽(GSH)的合成以及提高活性氧(ROS)的水平。但不幸的是,尽管这些相关的铁死亡诱导剂能够诱导铁死亡,并产生具有免疫原性细胞死亡(ICD)特征的免疫原性,从而增强 T 细胞浸润,但肿瘤细胞中 PD-L1 表达的上调会阻碍细胞毒性 T 细胞的识别,最终导致免疫抑制。
因此,铁死亡与免疫检查点阻断疗法(ICB)相结合,是一种有前景的癌症协同策略。然而,但实体瘤的缺氧微环境,给铁死亡诱导和免疫刺激的有效性带来了重大挑战。
2025 年 11 月 7 日,沈阳药科大学张申武教授、罗聪教授及深圳大学林静教授团队合作,在 Cell 子刊 Cell Reports Medicine 上发表了题为:Fluorinated prodrug-engineered nano-remodeler relieves tumor hypoxia for dual-enhanced ferroptosis-immunotherapy 的研究论文。
该研究开发了一种氟化前药工程化纳米重塑剂,其由二硫键连接的氟化前药 JQ1(一种PD-L1抑制剂)和索拉非尼(Sor,一种铁死亡诱导剂)精心共组装而成。其通过增加缺氧实体瘤中的氧气供应,显著提高了索拉非尼的铁死亡诱导效率和抗肿瘤免疫原性,从而与 JQ1 产生高度协同的铁死亡-免疫治疗,在多种肿瘤模型中有效抑制了肿瘤生长,且未出现明显毒性。

铁死亡被认为是一种受调控的细胞死亡形式,其特征在于铁依赖性的脂质过氧化以及显著的免疫原性。
然而,研究团队观察到,实体瘤的缺氧肿瘤微环境严重限制了对铁死亡的诱导和抗肿瘤免疫反应,同时促进了 PD-L1 的表达,从而进一步削弱了肿瘤免疫治疗的效果。
在这项最新研究中,研究团队开发了一种氟化前药工程化纳米重塑剂,来逆转实体瘤中的缺氧和免疫抑制的肿瘤微环境,以增强铁死亡/免疫调节驱动的抗肿瘤治疗。这是一种还原敏感型药物(FSSJ),其整合了含氟修饰、响应模块和 PD-L1 抑制剂,包含全氟辛酸、二硫键和 JQ1。与非含氟前药(HSSJ)相比,FSSJ 能自发与索拉非尼(Sor)共组装成相对稳定的无载体纳米药物。同时,对 DSPE-PEG2K 进行修饰以形成纳米组装体(NA),以提高体外稳定性。
该研究所制备的氟化前药工程化纳米重塑剂(FJSO NA)具有高氧溶解度。在肿瘤部位,由于低氧分压,氧气得以释放,有助于缓解实体瘤中的缺氧状态,下调 PD-L1 表达,并提高铁死亡的诱导效率和抗肿瘤免疫原性。此外,释放的索拉非尼诱导肿瘤铁死亡并引发免疫细胞死亡(ICD),从而与 JQ1 联合产生了高度协同的铁死亡-免疫治疗(ferroptosis-immunotherapy)。
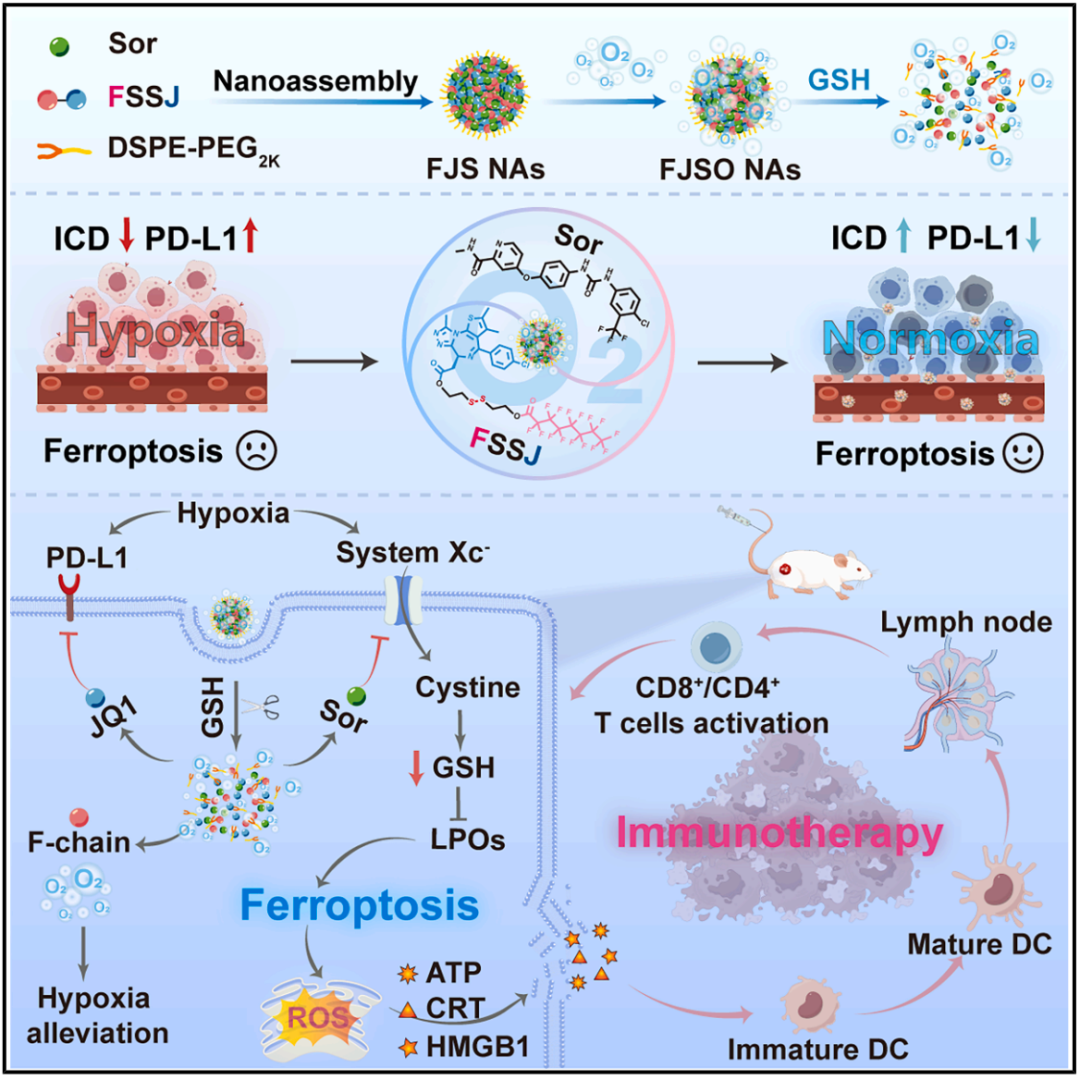
最终,该纳米重塑剂在多种肿瘤模型中有效抑制了肿瘤生长,且未出现明显毒性。该研究为通过缓解实体瘤缺氧微环境以增强铁死亡的抗肿瘤免疫疗法开辟了一个充满希望的方向。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


