《自然·癌症》:γδ T细胞惊现促癌黑暗面!
来源:奇点糕 2023-08-10 11:42
Lydia Lynch等人揭示,正常组织或肿瘤组织中的γδ T细胞具有明显异质性,分别具有细胞毒性和促进伤口愈合的功能。对此,他们通过优化细胞扩增方法,获得了杀伤、代谢能力增强的γδ T细胞
γδ T细胞是一类“非常规” T细胞,仅占外周血T细胞群体中的一小部分。
不走寻常路的γδ T细胞,与其它T细胞上的抗原受体(TCR)组成结构不同,而且活化过程不依赖于MHC-抗原的配对识别。组织稳态发生变化时,γδ T细胞能够迅速响应,活化后快速产生细胞因子来对抵御病原体感染或抗肿瘤。这些特性,使得γδ T细胞成为细胞过继免疫治疗的强力候选者。此外,基于癌症基因组图谱(TCGA)的分析表明,γδ T细胞与大多数实体瘤的积极预后相关,是对预后最有利的一类免疫细胞[1]。
然而,看似美好的γδ T细胞似乎对我们有所隐瞒。
美国哈佛大学医学院的Lydia Lynch和她的同事们发现,结直肠癌肿瘤内,除了行使细胞毒性功能的γδ T细胞,还存在促进肿瘤细胞生长的γδ T细胞,表达与伤口愈合相关的双调蛋白(AREG)。不仅如此,他们开发了一种扩增方式对γδ T细胞进行优化,使其过继转移给结直肠癌小鼠后,不再产生AREG,而是仅表现为细胞毒性表型,明显抑制肿瘤生长[2]。
文章于近日发表在《自然·癌症》期刊上。

论文首页截图
基于TCGA数据库,Lydia Lynch等人首先发现,在卵巢癌、肺腺癌、子宫内膜癌中,高水平的肿瘤浸润γδ T细胞与患者更高的生存率相关,但在结直肠癌中并没有显著相关性。也就是说,在不同癌症类型中,γδ T细胞可能有着不止一副面孔。
为了探索是否具有异质性,研究者们对子宫内膜癌和结直肠癌肿瘤内的γδ T细胞,展开一系列单细胞RNA测序(scRNA-seq)等分析。
结果显示,γδ T细胞的基因表达模式更接近于自然杀伤细胞(NK)和先天性淋巴细胞(ILCs),而不是CD8+T细胞、CD4+T细胞。肿瘤内的γδ T细胞高表达颗粒酶B、穿孔素、IFN-γ等细胞毒性效应分子,低表达PD-1、CTLA4等免疫检查点。
根据功能表型,研究者们发现,子宫内膜癌肿瘤浸润γδ T细胞整齐划一,只有一种表型,即细胞毒性。结直肠癌肿瘤内的γδ T细胞却没有统一干着杀伤肿瘤细胞的活儿,而是分为细胞毒性、伤口愈合、中间过渡这三种表型。
具体来看,细胞毒性效应分子和免疫检查点在细胞毒性表型γδ T细胞中表达量最高,在伤口愈合表型γδ T细胞表达量中最低。能够促进组织修复的双调蛋白(AREG)只在伤口愈合表型和中间过渡表型γδ T细胞中表达,且在前者高表达。
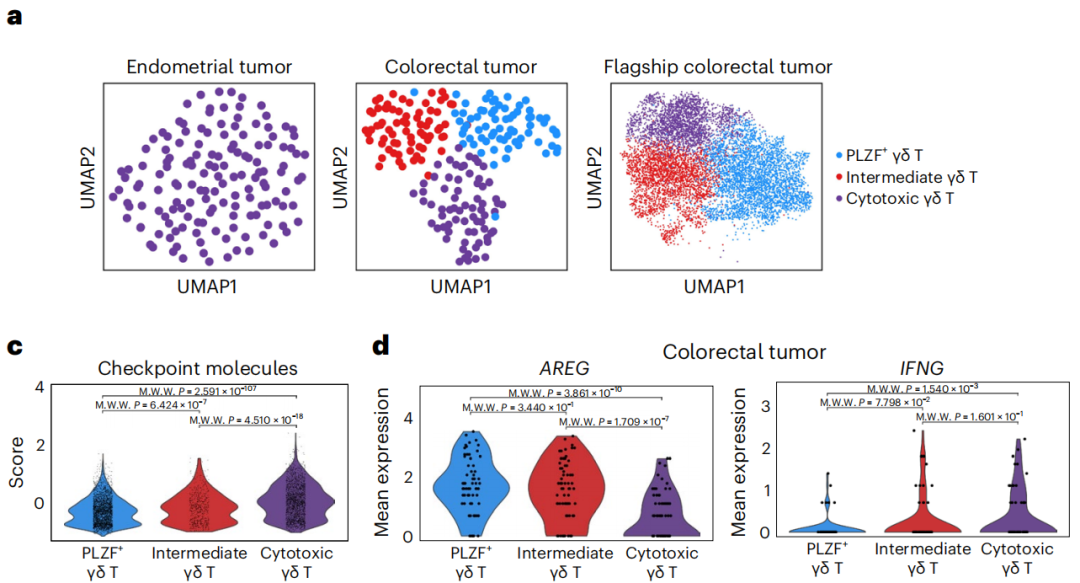
结直肠癌肿瘤里有三股γδ T细胞势力
接下来,研究者们发现,实际上无论是在健康组织还是肿瘤组织中,NK细胞、树突状细胞等多种免疫细胞都有表达AREG蛋白。只不过,唯独γδ T细胞会在肿瘤组织中上调表达AREG。
与健康组织相比,结直肠癌组织中,γδ T细胞表达的AREG水平上调,尤其是在“冷肿瘤”——没有DNA错配修复缺陷(MMRp)的结直肠癌中,AREG水平更高;而在对免疫治疗敏感、具有DNA错配修复缺陷(MMRd)的结直肠癌中,γδ T细胞表达的IFN-γ水平上调。
与AREG、IFN-γ表达水平变化相符,不同功能表型的γδ T细胞分布情况有变。中间过渡表型γδ T细胞在健康结直肠组织中占主导地位,在肿瘤中减少;细胞毒性和伤口愈合表型γδ T细胞在肿瘤中聚集,且分别在MMRd、MMRp结直肠癌中所占比例更高。
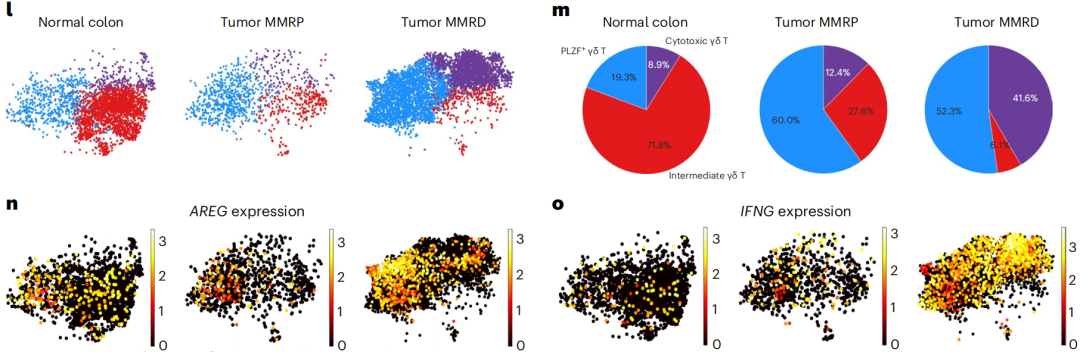
不同类型结直肠癌中的γδ T细胞表型分布情况,以及AREG或IFN-γ表达情况(每张小图左→右:健康组织、MMRP肿瘤、MMRD肿瘤)
研究者们进一步对不同表型γδ T细胞的免疫特征进行描述。结果显示,IFNγ+TIGIT+γδ T细胞表现为细胞毒性表型,AREG+NKp80+细胞表现为伤口愈合表型。还有一类同时表达TIGIT和NKp80的γδ T细胞群体,即中间过渡表型。
通过在培养皿中进行细胞划痕实验以模拟组织创伤,他们发现,AREG+NKp80+γδ T细胞能够诱导两种人结直肠癌细胞(SW480、HCT116)增殖,拥有促进肿瘤组织修复的能力。如果使用西妥昔单抗处理来阻断AREG与其受体EGFR的互作,可以抑制AREG+NKp80+γδ T细胞的效果。
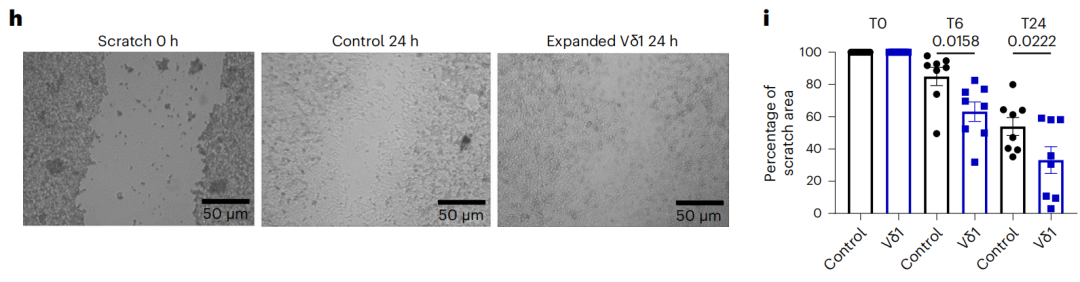
AREG+NKp80+γδ T细胞促进结直肠癌细胞增殖,修复划痕
以上结果指出,结直肠癌肿瘤中的γδ T细胞存在两股势力。一方通过表达IFN-γ等效应因子,担负着杀伤肿瘤细胞的作用;另一方则是通过表达AREG蛋白帮肿瘤救死扶伤,促进肿瘤细胞增殖、修复伤口。还有一部分中间过渡γδ T细胞,兼具两大势力的表型。
既然如此,γδ T细胞要想成为细胞过继免疫疗法的候选者,得想办法抑制其表达AREG蛋白才行,不然反向成为给肿瘤加油鼓劲了。
于是,研究者们使用IL-1、IL-18、αCD3、αCD2等因子在体外诱导γδ T细胞扩增,并进行一系列条件优化。最终,他们开发出一种能够增强γδ T细胞的细胞毒性并提高其代谢活性的扩增方法。

γδ T细胞得改造一下才能用[3]
在结直肠癌患者来源的异种移植瘤小鼠模型中,研究者们对γδ T细胞过继免疫治疗的效果进行验证。
结果显示,将强化过的γδ T细胞转移到携带肿瘤的小鼠体内后,与对照组(PBS处理)相比,小鼠肿瘤生长得到显著抑制。这些γδ T细胞在肿瘤微环境中稳定扩增,表达更高水平的IFN-γ,更重要的是,在肿瘤以及其它任何器官组织中都不产生AREG蛋白。
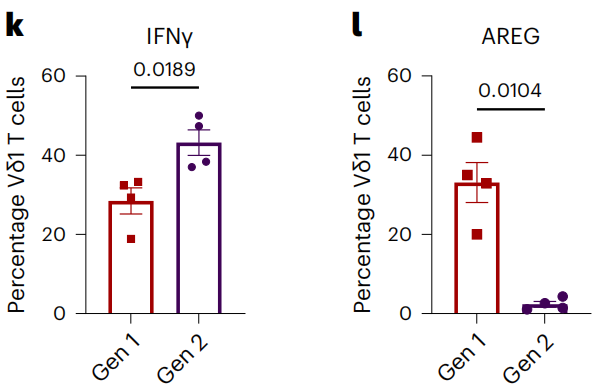
强化过的γδ T细胞几乎不表达AREG(第一代方法Gen1优化后得到第二代Gen2)
总体来说,Lydia Lynch等人揭示,正常组织或肿瘤组织中的γδ T细胞具有明显异质性,分别具有细胞毒性和促进伤口愈合的功能。对此,他们通过优化细胞扩增方法,获得了杀伤、代谢能力增强的γδ T细胞,在小鼠体内表现出更强的抗肿瘤效应,不再表达AREG蛋白,这为结直肠癌免疫治疗提供了新的思路。
参考文献:
[1]Gentles, A. J. et al. The prognostic landscape of genes and infiltrating immune cells across human cancers. Nat. Med. 21, 938–945 (2015).
[2]https://www.nature.com/articles/s43018-023-00589-w
[3]Coffelt, S.B., Suzuki, T. The two sides of the γδ T cell coin. Nat Cancer (2023). https://doi.org/10.1038/s43018-023-00587-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


