Signal Transduction and Targeted Therapy: 激活的STING触发非干扰素相关功能的离子通道
来源:生物谷原创 2023-10-30 10:18
STING(干扰素基因的刺激物)作为质子释放到胞浆中的直接介质,从而引发非规范的LC3B(轻链3B)脂化和NLRP3
最近,《科学》杂志上发表的一项研究提供了令人信服的证据,证明当转位到高尔基体时,STING(干扰素基因的刺激物)作为质子释放到胞浆中的直接介质,从而引发非规范的LC3B(轻链3B)脂化和NLRP3(含NOD样受体家族的吡咯域3)炎症小体激活。这项研究为cGAS-STING通路参与非干扰素相关功能提供了一个新的视角。

图片来源: https://doi.org/10.1038/s41392-023-01633-y
近日,来自浙江大学的研究者们揭示了激活的STING可以触发非干扰素相关功能的离子通道。CGAS(环状GMP-AMP合成酶)负责检测胞浆DNA,指示异物,如病毒,或对宿主DNA的损伤。当cGAS与胞浆DNA结合时,cGAS以ATP和GTP为底物催化合成环核苷酸,激活STING。活性刺蛋白经历构象变化,并从内质网重新定位到高尔基体。在这些间隔内,STING参与多种途径,包括干扰素诱导、非典型自噬和NLRP3炎症小体激活。这些值得注意的发现丰富了我们对刺痛多方面作用的了解。
简而言之,STIN刺激干扰素产生的机制得到了很好的描述。然而,其他两种已知的非干扰素功能的确切机制仍不清楚,值得进一步研究。先前的研究已经证明,cGAS-STING轴激活NLRP3炎症体不依赖于干扰素的诱导,并且可以触发FIP200非典型的非典型的LC3B脂化,从而启动“非典型的自噬”。
有趣的是,流感病毒M2孔蛋白引起的质子泄漏被发现与非典型的LC3B脂化和NLRP3炎症体激活有关。鉴于这些过程与酸性细胞器(如高尔基体和内小体)的质子泄漏之间已建立的联系,研究人员初步探索了细胞器质子泄漏可能参与刺痛诱导的LC3B脂化和炎性小体激活。
为了评估这一点,他们使用了高尔基体特异的pH报告器(SEPmRuby),它在pH升高时显示荧光。
通过这种方法,他们成功地观察到了刺痛的激活导致高尔基体内pH的增加。值得注意的是,尽管观察到的酸性细胞器质子外流可能与非典型的LC3B脂化和NLRP3炎症体的启动有关,但还没有通过全基因组CRISPR筛选来调节这种离子流的特定基因。
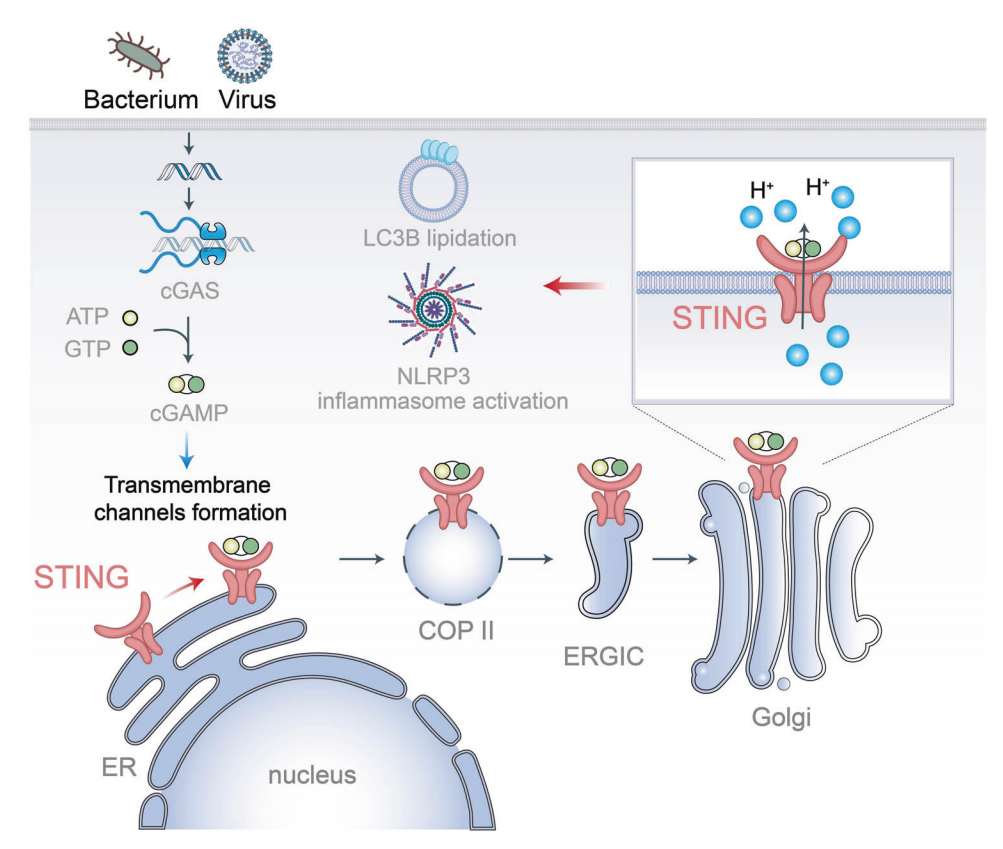
激活的STING作为离子通道的功能模型
图片来源: https://doi.org/10.1038/s41392-023-01633-y
总之,鉴于STING在宿主免疫、细胞衰老和抗肿瘤反应中的重要意义,人们对开发能够激活或抑制STING活性的药理药物有相当大的兴趣。STING离子通道活性的发现为设计调节刺痛功能的治疗干预开辟了新的可能性。这些进展为创新治疗方法的发展带来了希望。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


