Nature:IL-33驱动免疫革命——开启胰腺癌治疗新篇章
来源:生物探索 2025-01-25 09:30
IL-33作为一种强大的免疫调控因子,为打破“免疫冷”肿瘤提供了全新视角。
Nature的研究报道“IL-33-activated ILC2s induce tertiary lymphoid structures in pancreatic cancer”,聚焦于一种由组织损伤释放的报警素分子——白细胞介素-33(Interleukin-33, IL-33)。研究人员发现,IL-33不仅能激活天然淋巴细胞(Group 2 Innate Lymphoid Cells, ILC2s),还可以通过这些细胞的协作作用,显著促进TLSs的形成。ILC2细胞的独特功能在于,它们能够迁移至肿瘤部位,与肿瘤相关的髓系细胞相互作用,共同驱动淋巴结构的生成。这一过程的分子机制清晰地展示了炎症信号如何通过IL-33-ILC2轴,转化为增强抗肿瘤免疫力的潜在治疗途径。
此外,这一发现不仅仅停留在基础研究层面。研究团队成功设计了一种优化的人源化IL-33蛋白,其显著增强了小鼠模型中的抗肿瘤免疫反应,为未来胰腺癌和其他免疫冷肿瘤的治疗带来了新希望。这项研究突破性地揭示了IL-33在免疫调控中的全新作用,同时也为开发下一代免疫治疗策略提供了科学依据。

胰腺癌的免疫挑战:如何激活沉睡的防御系统?
胰腺癌(Pancreatic Ductal Adenocarcinoma, PDAC)是人类致死率最高的恶性肿瘤之一,其五年生存率不足10%。这一严峻的现实与其独特的肿瘤微环境密切相关。PDAC通常被认为是一种“免疫冷”肿瘤,意味着肿瘤内部缺乏足够的免疫细胞浸润。免疫系统的“冷场效应”使得常规免疫治疗(如免疫检查点抑制剂)在PDAC中的效果远低于预期。这一特性不仅限制了免疫治疗的广泛应用,也促使研究人员探索更加有效的免疫激活手段。
为什么PDAC是“免疫冷”?
PDAC的“免疫冷”状态主要体现在其肿瘤微环境(Tumor Microenvironment, TME)的复杂性。正常情况下,免疫系统能够通过识别和攻击肿瘤细胞发挥作用。然而,在PDAC中,免疫细胞不仅数量稀少,还往往被免疫抑制信号所劫持。研究表明,PDAC中缺乏功能性效应T细胞(Effector T Cells)、B细胞和树突状细胞(Dendritic Cells),而免疫抑制性细胞如调节性T细胞(Regulatory T Cells, Tregs)和髓系抑制细胞(Myeloid-Derived Suppressor Cells, MDSCs)则占据主导地位。这种失衡的免疫生态系统使得PDAC成为一种“隐形敌人”,在免疫系统的视野中成功逃逸。
三级淋巴结构(TLSs):免疫调节的“秘密武器”
面对PDAC的免疫屏障,研究人员将目光聚焦于三级淋巴结构(Tertiary Lymphoid Structures, TLSs)。TLSs是一种异位形成的淋巴组织,通常出现在慢性炎症或某些肿瘤组织中。不同于先天存在的二级淋巴器官(如淋巴结),TLSs在局部病灶中自发形成,并能够为免疫细胞提供一个协调抗原识别和免疫攻击的“战场”。在许多研究中,TLSs被认为与肿瘤的良好预后密切相关。在PDAC患者中,肿瘤内部TLS的数量越多,患者的生存时间通常越长。
该研究进一步揭示了TLSs在免疫调节中的潜力。TLSs的形成依赖于炎症信号的激活,特别是淋巴毒素(Lymphotoxin, LT)通路的作用。而PDAC中的TLSs不仅能够增强抗肿瘤免疫力,还可能改变肿瘤微环境的“冷场”特性,使其更易于被免疫治疗所靶向。
尽管TLSs展现出了巨大的潜力,但如何高效地诱导TLSs的形成仍是研究人员面临的关键难题。研究发现,PDAC中TLSs的自然生成较为稀少,而激活其生成的信号和细胞来源尚未完全明确。幸运的是,随着对肿瘤免疫机制研究的深入,一些炎症信号分子,如白细胞介素-33(IL-33),被发现能够显著诱导TLSs的形成。
白细胞介素-33 (IL-33):从报警分子到免疫新星
白细胞介素-33(Interleukin-33, IL-33)是一种独特的细胞因子,因其能够在组织损伤时迅速释放而被称为“报警分子”(Alarmin)。IL-33以全长蛋白形式定位于细胞核,其N端具有核定位信号,C端则为“报警”活性区域。在组织损伤或炎症状态下,IL-33的C端结构被切割并释放至细胞外,与受体ST2结合后启动下游信号通路。这一信号通路激活多种免疫细胞,包括先天淋巴细胞(Innate Lymphoid Cells, ILCs)和T细胞等,从而触发一系列免疫反应。
IL-33的作用范围广泛,不仅参与了抗原递呈和炎症调控,还在肿瘤微环境中发挥了重要作用。然而,IL-33的功能具有“双刃剑”效应,其在不同的病理条件下既可能促进抗肿瘤免疫,也可能加剧肿瘤进展。
IL-33如何成为TLSs形成的关键诱导因子
研究表明,IL-33通过直接激活第二类先天淋巴细胞(Group 2 Innate Lymphoid Cells, ILC2s),显著促进三级淋巴结构(TLSs)的形成。该研究使用胰腺癌(PDAC)模型发现,IL-33的表达与TLSs密切相关。在具有较高TLS密度的肿瘤中,IL-33表达水平明显上升,且与患者更好的生存率相关。此外,在小鼠模型中,缺失IL-33的PDAC小鼠显示出显著减少的TLSs,进一步证明了IL-33在TLSs形成中的关键作用。
这一过程的核心在于IL-33与ILC2s的相互作用。IL-33通过ST2受体激活ILC2s,诱导其分泌淋巴毒素(Lymphotoxin, LT),这一信号对TLSs的形成至关重要。研究还发现,IL-33激活的ILC2s可以从肠道迁移至肿瘤部位,并与表达淋巴毒素β受体(LTβR)的髓系细胞协作,共同促进TLSs的生成。实验进一步证实,当小鼠接受重组IL-33(rIL-33)治疗后,其肿瘤内部的TLSs显著增加,同时免疫细胞浸润水平也有所提升。
在肿瘤微环境中的表现:希望还是双刃剑?
尽管IL-33在诱导TLSs方面展现出巨大的潜力,但其在肿瘤微环境中的角色却并非单一正向。研究指出,IL-33在不同的肿瘤背景中可能具有不同效应。例如,在胰腺癌模型中,IL-33激活TLSs的同时,也可能通过其他炎症通路间接支持肿瘤生长。
这种双重作用背后的原因在于IL-33与多种细胞类型的复杂相互作用。一方面,IL-33激活的TLSs能够吸引效应T细胞和B细胞等抗肿瘤免疫细胞,从而增强免疫反应;另一方面,IL-33也可能激活某些免疫抑制性细胞或促炎细胞,反而为肿瘤的进展提供“庇护所”。因此,如何在促进TLSs形成的同时,避免IL-33的副作用成为研究人员亟需解决的问题。
为了最大化IL-33的治疗潜力,研究团队开发了一种优化的人源化IL-33蛋白(H-e-rIL-33)。通过去除潜在的氧化位点并延长其半衰期,这种蛋白在小鼠模型中展现出更强的TLS诱导能力和抗肿瘤效果。特别是在胰腺癌模型中,优化后的IL-33不仅能够显著增强肿瘤内部的TLS密度,还显著抑制了肿瘤的生长。
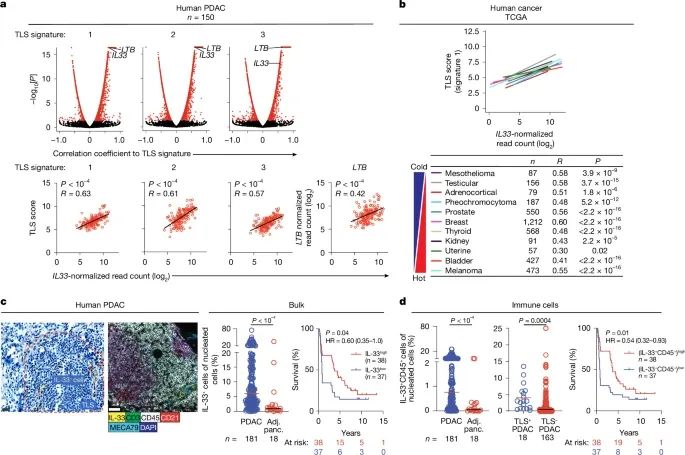
IL-33在胰腺癌(PDAC)以及其他肿瘤中的表达与三级淋巴结构(TLSs)形成和患者预后的关联(Credit: Nature)
IL-33与TLS转录特征的相关性分析
PDAC肿瘤中的TLS特征相关性(a, 上图): 在胰腺癌中,通过对肿瘤组织的大量mRNA表达数据进行无偏相关分析,发现TLS的三种转录特征(TLS signature 1、2和3)与肿瘤总体mRNA表达密切相关。
IL-33表达的相关性(a, 下图):PDAC肿瘤中IL-33的mRNA表达与TLS转录特征及淋巴毒素β(LTB)的表达呈显著正相关,表明IL-33可能参与TLS的生成和调控。
在其他人类肿瘤中的分析(b): 扩展至其他肿瘤类型后,IL-33的mRNA表达与TLS signature 1之间仍存在显著相关性,说明IL-33的作用可能具有普适性。
IL-33在肿瘤组织中的分布及细胞定位
组织免疫组化和免疫荧光(c): 通过免疫组化和免疫荧光技术,研究显示PDAC肿瘤中IL-33阳性细胞(IL-33⁺)主要分布于TLS区域,与周围组织形成明显对比(用红色虚线标出TLS位置)。此外,免疫荧光进一步展示了IL-33与CD45阳性免疫细胞(IL-33⁺CD45⁺细胞)的共定位。
IL-33表达与患者预后的关系
生存分析(c和d,): 在PDAC患者中,根据IL-33阳性细胞或IL-33⁺CD45⁺细胞的频率将患者分为高表达组和低表达组。生存曲线分析显示,IL-33表达较高的患者有更长的生存时间(显著高于低表达组)。这表明IL-33在PDAC中可能具有改善患者预后的潜力。 IL-33⁺细胞和IL-33⁺CD45⁺细胞的频率采用中位数划分高低组,组间差异通过Mann–Whitney U检验和对数秩检验进行统计学验证,结果显示差异显著。
ILC2细胞:肿瘤免疫调控的“隐形战士”
先天淋巴细胞(Innate Lymphoid Cells, ILCs)是一类在免疫防御中扮演重要角色的免疫细胞,根据功能和分泌的细胞因子被分为三种亚型:ILC1、ILC2和ILC3。其中,第二类先天淋巴细胞(Group 2 Innate Lymphoid Cells, ILC2s)因其在抗寄生虫感染、组织修复和炎症调控中的重要性,近年来备受关注。
ILC2细胞主要来源于骨髓中的共同淋巴祖细胞,随后分化并迁移到外周组织,如肺部、肠道和皮肤等屏障组织。在这些部位,ILC2细胞在感染和损伤中被激活,分泌IL-5和IL-13等细胞因子,招募嗜酸性粒细胞并调节局部炎症反应。此外,ILC2还通过分泌淋巴毒素(Lymphotoxin, LT)等分子,参与三级淋巴结构(TLSs)的形成。
ILC2细胞不同于传统的T细胞,它们无需抗原递呈即可被激活,这种快速反应的特性使其在免疫防御中扮演“第一响应者”的角色。然而,ILC2的作用远不止于此,在肿瘤微环境(Tumor Microenvironment, TME)中,它们正展现出不可忽视的潜力。
ILC2与IL-33的协同作用:如何驱动TLSs生成?
该研究明确指出,ILC2细胞在三级淋巴结构(TLSs)形成中起到关键作用,而这一过程的核心驱动力正是白细胞介素-33(IL-33)。IL-33通过与ILC2细胞表面的ST2受体结合,激活下游信号通路,促进ILC2的扩增和功能性因子分泌。
研究显示,ILC2在IL-33的刺激下分泌淋巴毒素(Lymphotoxin, LT)α和LTβ,这些因子能够与髓系细胞上的LTβ受体(LTβR)结合,驱动TLSs的形成。此外,ILC2细胞还能够分泌IL-13,进一步促进血管内皮细胞和淋巴细胞的募集,为TLSs的成熟创造有利条件。数据表明,在ILC2功能缺失的小鼠模型中,肿瘤内的TLSs数量显著减少,免疫细胞浸润水平降低,肿瘤生长得到加速。这些结果不仅验证了ILC2在TLSs生成中的核心作用,也强调了IL-33-ILC2轴作为抗肿瘤免疫靶点的潜力。
更重要的是,研究发现ILC2细胞的活性和迁移能力直接影响TLSs的分布。在小鼠模型中,注射重组IL-33(rIL-33)后,ILC2细胞显著增殖并向肿瘤区域迁移,TLSs密度大幅提高。这一协同作用揭示了通过调控ILC2和IL-33之间的信号通路,有望实现增强抗肿瘤免疫的目标。
ILC2迁移与肠道微生物的“秘密通道”
ILC2细胞的迁移能力是其发挥功能的重要基础,而肠道微生物群在这一过程中扮演了意想不到的角色。该研究通过小鼠模型发现,肠道微生物可以调节ILC2细胞的激活状态和迁移路径。具体而言,某些共生微生物能够通过产生短链脂肪酸(Short-Chain Fatty Acids, SCFAs),增强ILC2细胞对IL-33信号的敏感性,从而提高其迁移能力。
进一步实验显示,在去除肠道微生物的无菌小鼠中,ILC2细胞对IL-33刺激的反应显著减弱,TLSs的生成也相应受到抑制。这表明,肠道微生物不仅通过代谢产物调控ILC2,还可能通过影响肿瘤微环境中的代谢和炎症信号,为TLSs形成提供支持。
这一发现为ILC2的研究增添了新的维度。ILC2不仅仅是肿瘤免疫调控的“隐形战士”,它们还作为肠道微生物和肿瘤微环境之间的桥梁,为肿瘤免疫治疗带来了全新的可能性。
IL-33驱动的TLSs如何改变免疫治疗?
在肿瘤免疫研究中,小鼠模型始终是揭示机制和验证疗效的关键工具。该研究首次通过小鼠胰腺癌模型明确了IL-33在驱动三级淋巴结构(TLSs)形成中的核心作用。实验显示,在自然条件下,TLSs的形成与肿瘤内IL-33水平密切相关。当研究人员使用基因编辑技术敲除IL-33基因后,模型小鼠的肿瘤组织中TLSs显著减少,肿瘤微环境(TME)的免疫细胞浸润大幅下降。这直接导致肿瘤增长加速,生存期缩短,进一步凸显了IL-33在调控抗肿瘤免疫中的重要性。
更令人振奋的是,通过外源性注射重组IL-33(Recombinant IL-33, rIL-33),研究团队成功恢复了TLSs的形成。注射rIL-33后,肿瘤组织内的TLSs数量和成熟度显著提高,肿瘤内的效应T细胞和B细胞数量同步上升。这些免疫细胞在TLSs内被激活并迁移至肿瘤内部,与癌细胞直接对抗。在这一过程中,肿瘤的生长速度显著减缓,小鼠的生存率也得到明显改善。这些结果不仅证明了IL-33对TLSs形成的强大推动作用,也为其在免疫治疗中的应用提供了直接的实验依据。
人工优化IL-33蛋白:延长活性和增强效果
虽然天然IL-33在肿瘤免疫调控中具有独特优势,但其分子特性限制了临床应用的可能性。例如,天然IL-33的半衰期较短,容易被体内酶降解。此外,IL-33的激活过程依赖于特定的炎症信号,在某些条件下可能导致过度炎症反应,从而产生副作用。
为了解决这些问题,研究团队开发了一种优化的人工IL-33蛋白(Humanized-Engineered Recombinant IL-33, H-e-rIL-33)。这种改良蛋白通过去除IL-33中易被氧化的关键位点,并引入特定的结构修饰,显著延长了其体内活性。实验表明,H-e-rIL-33在小鼠模型中的半衰期是天然IL-33的两倍以上,同时其刺激TLSs形成的效果得到增强。
更重要的是,H-e-rIL-33的安全性得到了充分验证。在使用高剂量H-e-rIL-33的小鼠中,并未观察到显著的炎症副作用,而TLSs的生成和免疫细胞的浸润水平显著提高。这一突破性的优化设计为IL-33在肿瘤治疗中的应用铺平了道路。
IL-33在癌症免疫治疗中的未来前景
近年来,免疫治疗已成为癌症治疗领域的重要方向,但许多“免疫冷”肿瘤(如胰腺癌)对免疫治疗的响应率依然较低。白细胞介素-33(IL-33)作为一种关键的免疫调节因子,其独特的作用机制为解决这一难题提供了新希望。
未来,IL-33的应用前景不仅局限于胰腺癌,还可扩展至其他免疫治疗响应率较低的癌症类型。例如,在胶质瘤和肝细胞癌等“免疫冷”肿瘤中,IL-33可能通过类似机制提高免疫疗效。同时,IL-33还具有与现有免疫治疗方法(如免疫检查点抑制剂)的协同潜力。结合TLSs的形成与免疫检查点通路的激活,或许能够打造一种多层次、全方位的抗肿瘤免疫策略。
可能的挑战:炎症信号的双面性及副作用
尽管IL-33在肿瘤免疫调控中展现了巨大潜力,但其双重作用也为实际应用带来了挑战。作为一种“报警分子”,IL-33在炎症环境中的过度激活可能引发意想不到的副作用。例如,高水平IL-33可能导致慢性炎症、组织损伤,甚至促进某些肿瘤的进展。此外,不同肿瘤类型的微环境特性决定了IL-33的作用可能并不总是向着抗肿瘤的方向发展。在某些肿瘤中,IL-33可能通过激活调节性T细胞(Tregs)或免疫抑制性髓系细胞(MDSCs),反而为肿瘤提供庇护。
实验研究中还发现,IL-33的作用依赖于其浓度和作用时间的精准控制。剂量过低可能无法达到诱导TLSs的效果,而剂量过高则可能触发炎症失控。这一复杂性增加了临床转化的难度,如何在不同患者中个性化调控IL-33信号成为未来研究的重点。此外,IL-33信号的下游通路与多种免疫和炎症网络交织,进一步增加了副作用评估和调控的难度。
如何进一步优化和应用?
尽管存在挑战,IL-33的研究为癌症免疫治疗提供了许多重要启示。首先,优化IL-33的分子结构,提高其稳定性和组织特异性,是推动其临床应用的关键步骤。例如,改良的H-e-rIL-33通过结构修饰有效延长了体内半衰期,同时避免了过度激活炎症反应。这表明,通过生物工程手段对IL-33进行定制化设计,可以更好地适应不同肿瘤类型的治疗需求。
其次,结合精准医学理念,开发针对IL-33信号通路的个性化治疗方案同样至关重要。未来的研究可以通过高通量基因组学和单细胞转录组技术,全面分析不同患者中IL-33信号的激活模式,并据此设计适合的剂量和给药策略。此外,与现有免疫治疗方法的联用也值得进一步探索。例如,将IL-33与PD-1/PD-L1抑制剂联用可能产生协同效果,使得抗肿瘤免疫反应更加持久和强大。
最后,IL-33研究强调了肿瘤微环境的重要性。通过调控TLSs形成,IL-33不仅改善了“免疫冷”肿瘤的治疗前景,也为未来开发类似靶点提供了宝贵思路。其他能够驱动TLSs形成的分子,如淋巴毒素(Lymphotoxin),也可能成为潜在的研究热点。
IL-33作为一种强大的免疫调控因子,为打破“免疫冷”肿瘤提供了全新视角。尽管其临床转化仍面临若干挑战,但优化后的IL-33蛋白和日益深入的基础研究为其广泛应用铺平了道路。未来,随着技术的进步和对肿瘤微环境理解的加深,IL-33有望成为癌症免疫治疗中的重要武器,为更多患者带来康复的希望。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


