JITC:冷冻消融“加热”肿瘤!上海市胸科医院/中科院团队揭示增效肺癌免疫治疗的新策略
来源:奇点糕 2024-02-03 11:50
在临床实践中“不可手术NSCLC”同时包括了晚期和早期患者,或许安全微创的冷冻消融不只能助力晚期NSCLC免疫治疗,还能帮一把早期免疫新辅助/辅助治疗,带来更多的治愈希望。
近日,上海交通大学附属胸科医院孙加源、中国科学院分子细胞科学卓越创新中心季红斌团队在Journal for ImmunoTherapy of Cancer期刊共同发表最新研究成果,首次揭示冷冻消融(cryoablation)可通过STING依赖性I型干扰素(IFN)信号通路,正向调节非小细胞肺癌(NSCLC)肿瘤局部和全身的免疫微环境,从而与现有肺癌免疫治疗实现协同增效[1]。

论文首页截图
作为癌症局部治疗手段——消融中的一种,冷冻消融既可用于早期可手术NSCLC,也能用于转移性晚期患者的治疗,它的原理用两个字概括那就是“速冻”,即用经皮穿刺针向肿瘤部位快速注入氮气、氩气等气体,瞬间营造零下140度以下的低温来杀死癌细胞。
在免疫治疗时代,这些被冷冻消融干掉的癌细胞和组织,可就是绝佳的新抗原来源了,而且冷冻消融微创的特点,也使其非常适合参与联合治疗。但冷冻消融能不能用,不能只看理论上的可能性,还得通过研究来确证协同增效作用,而此前的同类研究[2-3]尚未涉及NSCLC这个大Boss。
上海市胸科医院/中科院团队首先分析了接受冷冻消融的早期NSCLC患者外周血样,发现在冷冻消融有效局部控制患者肿瘤后,CD8+T细胞占比和IL-2/11/29等多种炎症标志物均显著上升,同时多数患者血样中可观察到Foxp3+调节性T细胞(Treg)的显著减少;且小鼠实验中,冷冻消融还触发了“远隔效应”(abscopal effect),杀伤了小鼠对侧肺的肿瘤。
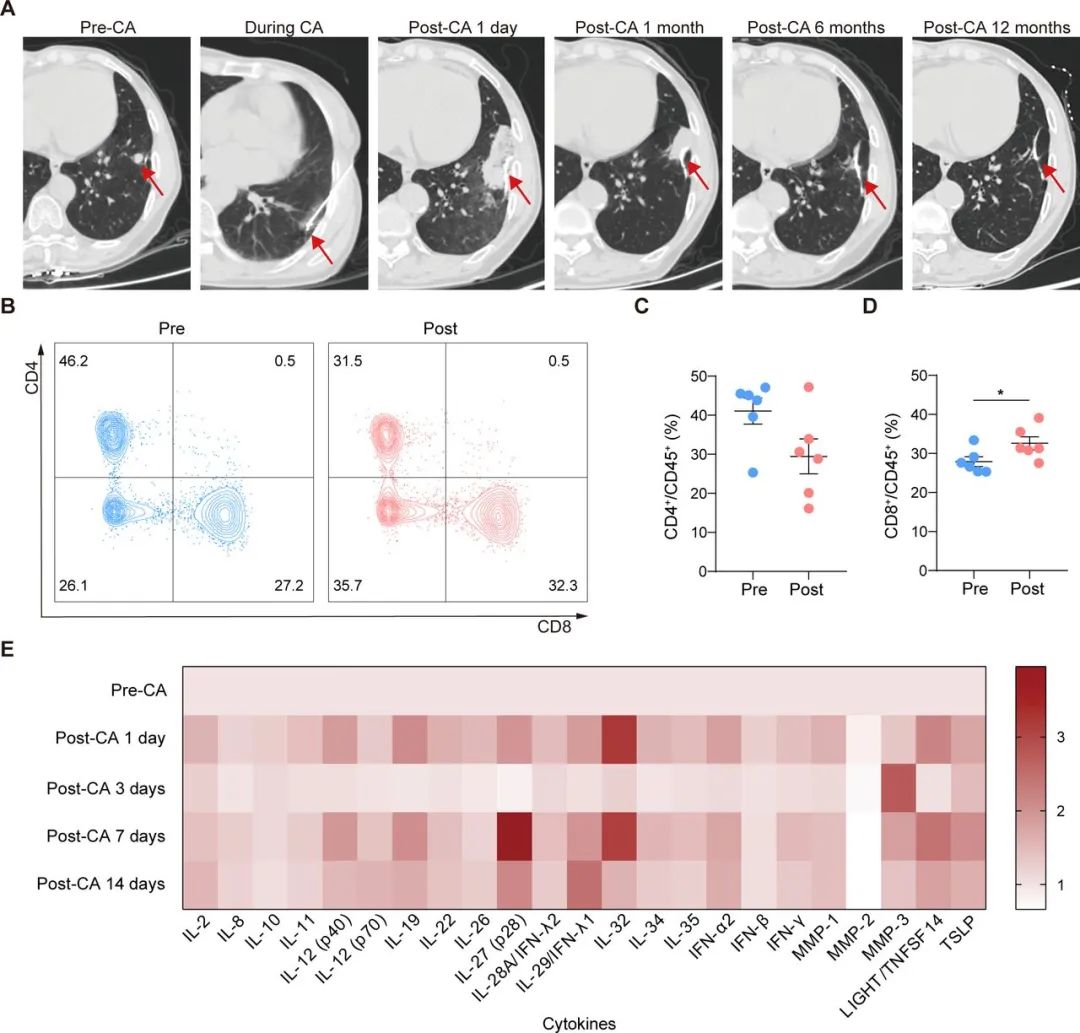
冷冻消融可有效控制人类患者肿瘤增殖,并在小鼠实验中实现远隔效应
上述发现特别是远隔效应被触发,意味着冷冻消融的免疫调节作用很可能不局限于肿瘤局部,例如小鼠对侧肺肿瘤也存在相似的炎症相关信号通路上调,例如IFN-α/β/γ水平显著上调,它们各自调控的炎症和免疫通路也都显著富集;浸润增多的免疫细胞,则主要是NK细胞和CD8+T细胞(主要为IFN-γ+或TNF-α+CD8+TILs),肿瘤中的PD-L1表达也上调了。
研究者们进一步专门分离了免疫细胞,并进行单细胞测序和基因集富集分析,证实与假处理对照组相比,冷冻消融组小鼠肿瘤内浸润的CD8+T细胞,会在分化过程中的关键阶段受到STING依赖性I型干扰素信号的显著影响,使效应CD8+T细胞占比相对上升;而增多的I型干扰素,则是由受冷冻消融调控的单核细胞和树突状细胞等髓系细胞产生的。
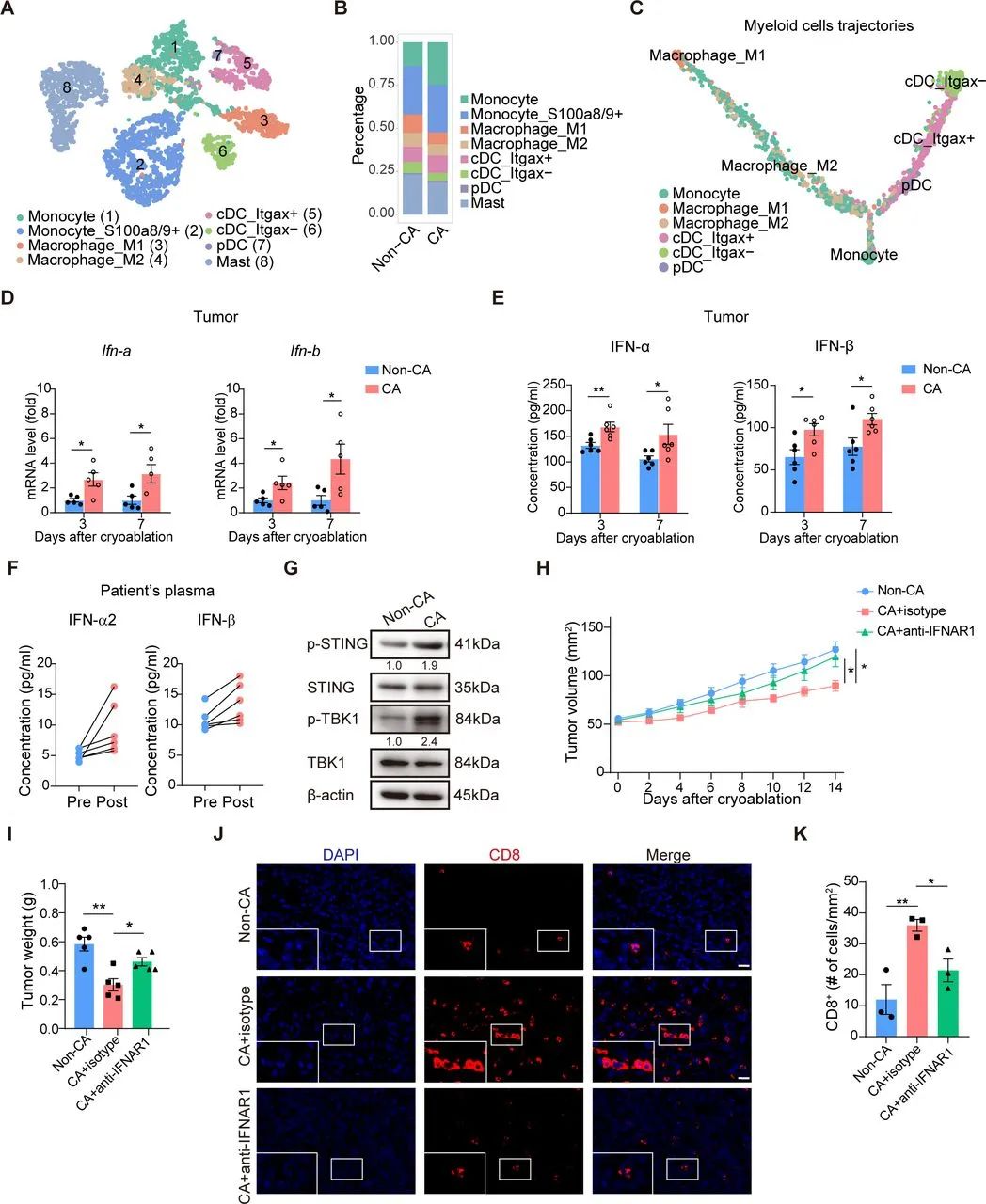
冷冻消融可调控肿瘤相关髓系细胞,激活STING依赖性I型干扰素信号
单独使用就有这么明确的免疫调节效应,冷冻消融在接下来的动物实验中,能够增效PD-1抑制剂、更好地抑癌并延长小鼠生存期也就顺理成章了,研究者们还基于这些发现,初步尝试用冷冻消融+PD-1抑制剂联合方案治疗了6例不可手术NSCLC患者(均为初治),使4例患者达到客观缓解,且肿瘤活检样本中也可见CD8+T细胞浸润的显著增多。
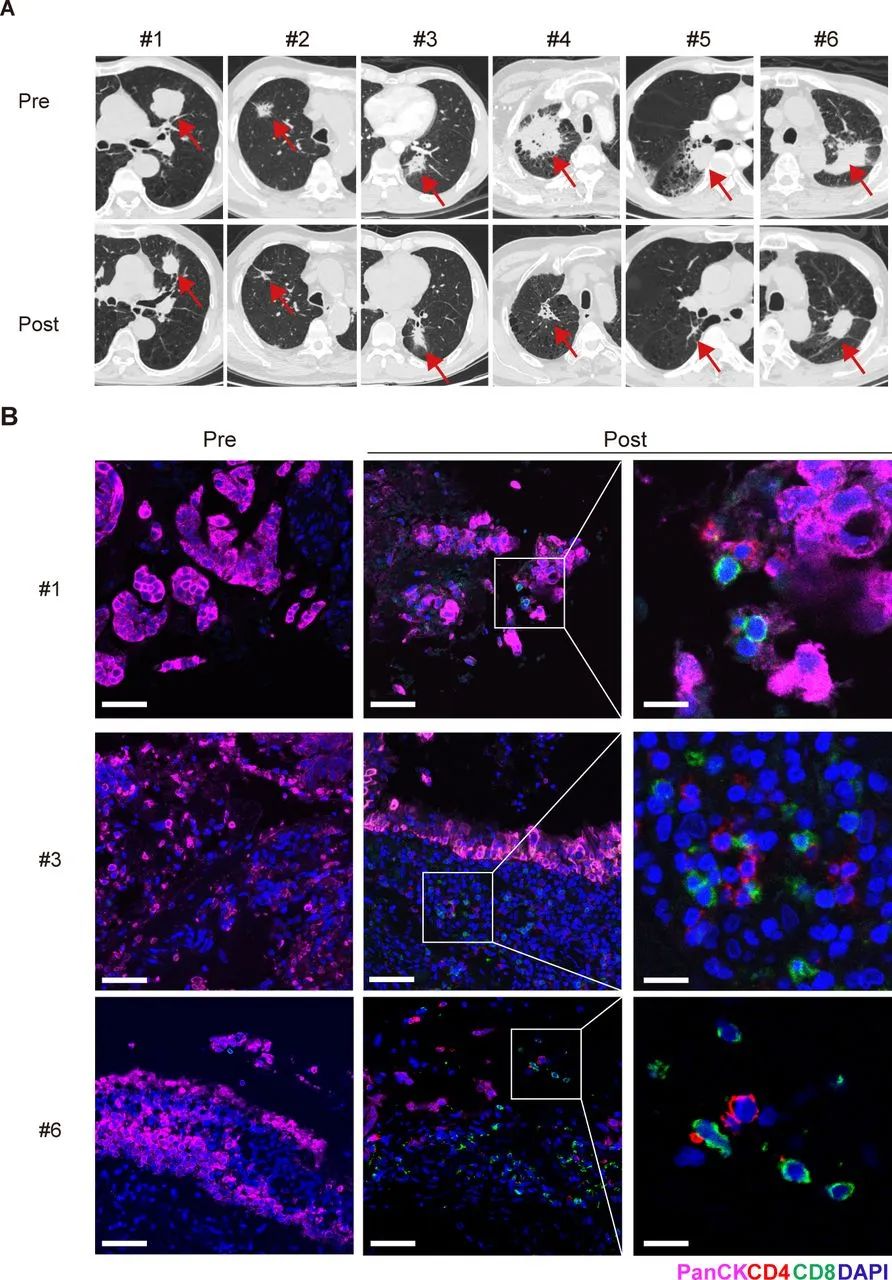
冷冻消融+PD-1抑制剂联合方案治疗不可手术NSCLC的初步成果
6例患者就有4例缓解,66.7%的客观缓解率(ORR)确实相当好看了,而且在临床实践中,“不可手术NSCLC”可是同时包括了晚期和早期患者,或许安全微创的冷冻消融不只能助力晚期NSCLC免疫治疗,还能帮一把早期免疫新辅助/辅助治疗,带来更多的治愈希望。就算不展望那么美好的未来,用冷冻把肿瘤微环境“冻热”也够有趣了,对吧?
参考文献:
[1]Gu C, Wang X, Wang K, et al. Cryoablation triggers type I interferon-dependent antitumor immunity and potentiates immunotherapy efficacy in lung cancer[J]. Journal for ImmunoTherapy of Cancer, 2024, 12(1): e008386.
[2]Benzon B, Glavaris S A, Simons B W, et al. Combining immune check-point blockade and cryoablation in an immunocompetent hormone sensitive murine model of prostate cancer[J]. Prostate Cancer and Prostatic Diseases, 2018, 21(1): 126-136.
[3]Zhu C, Lin S, Liang J, et al. PD-1 blockade enhances the anti-tumor immune response induced by cryoablation in a murine model of renal cell carcinoma[J]. Cryobiology, 2019, 87: 86-90.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


