重磅研究!吉林大学的研究者们揭示了抑制唾液酸微生物群-肠道-乳腺轴缓解乳腺炎
来源:生物谷原创 2023-05-10 15:27
肠道微生物群,已被证明是影响生理稳态和疾病结果的最重要调节因子之一。大量研究表明,肠道微生物群通过营养吸收、屏障维持、免疫和代谢调节以及破坏肠道微生态来调节宿主健康。
肠道微生物群,已被证明是影响生理稳态和疾病结果的最重要调节因子之一。大量研究表明,肠道微生物群通过营养吸收、屏障维持、免疫和代谢调节以及破坏肠道微生态来调节宿主健康。
通常,源自肠道微生物群的代谢改变是介导宿主-微生物群相互作用和影响疾病进展的最直接方式,而且肠道微生态失调产生的代谢产物增加了患病风险。Koh等人发现,肠道微生物群产生的组氨酸衍生的咪唑丙酸盐通过p38介导的雷帕霉素复合物1的机制靶点的激活来损害葡萄糖耐受性和胰岛素信号传导。
此外,三甲基-5-氨基戊酸(TMAVA)的肠道微生物群产生通过减少脂肪酸氧化促进心脏肥大。这些结果表明,探索宿主或微生物群介导的代谢变化对于深入了解肠道微生物群相关远端疾病的发病机制很重要。

图片来源:https://doi.org/10.1186/s40168-023-01528-8
近日,来自吉林大学的研究者们在Microbiome.杂志上发表了题为“Sialic acid exacerbates gut dysbiosis-associated mastitis through the microbiota-gut-mammary axis by fueling gut microbiota disruption”的文章,该研究表明特异性唾液酸酶抑制剂扎那米韦治疗小鼠降低了唾液酸(SA)的产生和莫拉克菌科的丰度,并改善了由患有严重急性呼吸系统综合征相关乳腺炎的奶牛瘤胃微生物群移植引起的小鼠乳腺炎。
乳房炎是人类和动物最严重的疾病之一,尤其是在奶牛场。越来越多的证据表明,高谷物饮食和低膳食纤维诱导亚急性瘤胃酸中毒(SARA)引起的胃肠道微生态失调与乳腺炎的发生和发展有关,但其潜在机制尚不清楚。
在本研究中,研究者发现患有严重急性呼吸系统综合征相关乳腺炎的奶牛瘤胃代谢谱发生了改变,尤其是唾液酸水平增加。抗生素治疗小鼠(而非健康小鼠)SA的摄入诱发了显著的乳腺炎,也诱导了粘膜和全身炎症反应,结肠和肝脏损伤增加以及一些炎症标志物就是明证。此外,抗生素引起的肠道微生态失调损害了肠道屏障的完整性,SA治疗加重了这种情况。
SA增强了抗生素治疗引起的血清LPS水平,导致乳腺和结肠中TLR4-NF-κB/NLRP3通路的激活增加。此外,SA促进了抗生素引起的肠道微生态失调,尤其是增强了肠杆菌科和阿克曼菌科,这与乳腺炎参数相关。SA抗生素治疗小鼠的粪便微生物群移植模拟了受体小鼠的乳腺炎。
体外实验表明,SA促进大肠杆菌生长和毒力基因表达,导致巨噬细胞产生更高的促炎细胞因子。用钨酸钠靶向抑制肠杆菌科或用共生罗伊氏乳杆菌治疗可减轻SA促进的乳腺炎。
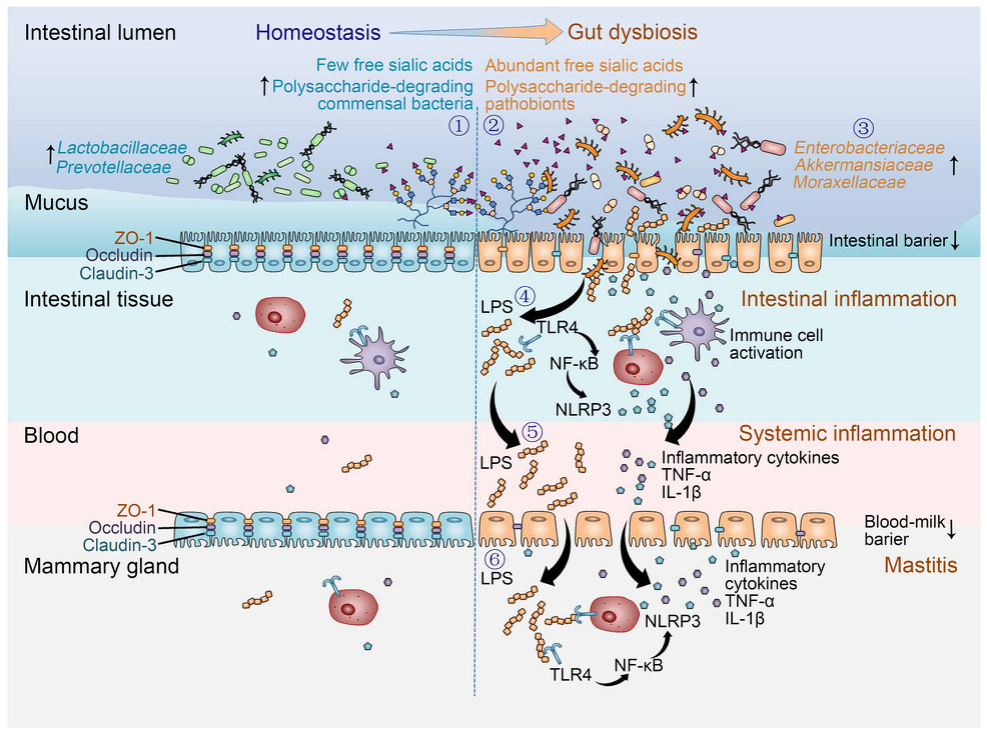
SA通过微生物群-肠道-乳腺轴促进肠道微生态失调诱导的乳腺炎的机制图
图片来源:https://doi.org/10.1186/s40168-023-01528-8
综上所述,SA代谢的增加促进了小鼠肠道微生态失调引起的乳腺炎的发展。其潜在机制与肠杆菌科的过度表达以及随后TLR4-NF-κB/NLRP3信号引起的肠道屏障损伤和全身炎症有关。相反,肠杆菌科的耗竭、共生菌的治疗和游离SA的减少改善了小鼠肠道微生态失调相关的乳腺炎。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


