施松涛/陈畅团队揭示细胞凋亡释放硫化氢抑制Th17细胞分化
来源:生物世界 2023-12-21 10:43
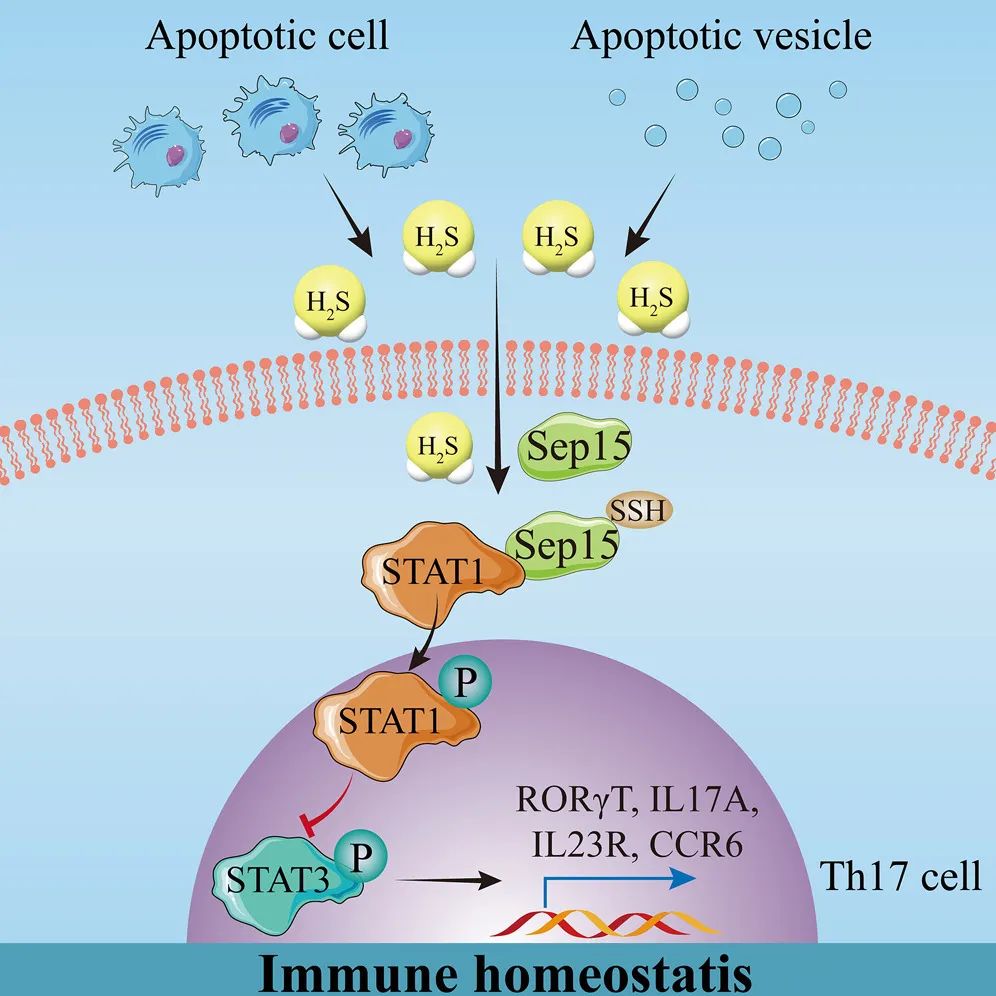
该研究揭示了细胞凋亡在维持H2S稳态中的一个之前未知的作用,以及H2S通过硫化Sep15C38来调控Th17细胞分化的独特作用。
中山大学施松涛、中国科学院生物物理研究所陈畅等人在 Cell 子刊 Cell Metabolism 上发表了题为:Apoptosis releases hydrogen sulfide to inhibit Th17 cell differentiation 的研究论文【1】。
该研究揭示了细胞凋亡在维持H2S稳态中的一个之前未知的作用,发现了凋亡细胞产生的凋亡囊泡(apoV)继承了H2S生成能力,并进一步解析了H2S通过对硒蛋白F(Sep15)的C38位点(Sep15C38)的硫化作用来调控Th17细胞分化的机制。

早在2015年,施松涛团队就在 Immunity 期刊发表论文【2】,揭示了内源性H2S对于维持免疫稳态至关重要,而H2S的缺乏与T细胞相关免疫疾病有关。由于凋亡缺陷和H2S缺乏都可能导致严重的免疫疾病,因此,凋亡过程可能与内源性H2S的产生有关。
凋亡囊泡(Apoptotic Vesicles,apoV)是由凋亡细胞释放的代谢性细胞外囊泡(EV)。凋亡囊泡从其母细胞中继承了多种成分,包括DNA、RNA、蛋白质和脂质,可以调控接受它们的器官和组织。此外,施松涛团队之前的研究表明,间充质干细胞(MSC)和T细胞都有产生H2S的能力。然而,细胞外囊泡是否能够继承其母细胞产生H2S的能力仍然是未知的。
在这项最新研究中,研究团队证明了细胞凋亡是维持内源性H2S稳态所必需的。H2S通过对硒蛋白F(Sep15)的C38位点(Sep15C38)的硫化作用,来抑制Th17细胞的异常激活。
具体来说,该研究发现,凋亡缺陷的小鼠模型表现出显著降低的H2S水平以及Th17细胞的异常分化,而这些细胞可以通过额外的H2S得到挽救。此外,凋亡细胞和凋亡囊泡(apoV)表达关键的H2S生成酶并产生大量H2S,这表明凋亡代谢是H2S的重要来源。从机制上说,H2S通过对硒蛋白F(Sep15)的C38位点(Sep15C38)的硫化作用,促进信号转导和转录激活因子1(STAT1)磷酸化并抑制STAT3磷酸化,导致Th17细胞分化的抑制。
凋亡缺陷与系统性红斑狼疮(SLE)密切相关,SLE患者的循环系统和组织中Th17细胞数量显著增加,而Th17细胞的浸润导致组织炎症和器官损伤。抑制SLE患者Th17细胞的分化和存活是一种有前途的方法,可以减轻炎症损伤并延缓疾病进展。
该研究还表明,凋亡囊泡(apoV)从其母细胞中继承了产生H2S的能力,这与apoV介导的系统性红斑狼疮(SLE)小鼠模型治疗效果密切相关。

综上所述,该研究揭示了细胞凋亡在维持H2S稳态中的一个之前未知的作用,以及H2S通过硫化Sep15C38来调控Th17细胞分化的独特作用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


