Trends Pharmacol Sci:克服寡核苷酸在组织递送中的挑战
来源:生物谷 2021-06-08 10:11
近日,爱奥尼斯制药公司在Trends Pharmacol Sci杂志上发表了题为"Overcoming the challenges of tissue delivery for oligonucleotide therapeutics"的文章。合成治疗性寡核苷酸(STO)是继小分子和蛋白质疗法之后制药行业第三个真正的药物发现平台。到目前为止,已有13个ST
近日,爱奥尼斯制药公司在Trends Pharmacol Sci杂志上发表了题为"Overcoming the challenges of tissue delivery for oligonucleotide therapeutics"的文章。合成治疗性寡核苷酸(STO)是继小分子和蛋白质疗法之后制药行业第三个真正的药物发现平台。到目前为止,已有13个STO获得监管机构的批准,其中100多个正处于不同的临床试验阶段。STO通过Watson-Crick碱基配对与细胞中的靶RNA或DNA杂交,发挥其药理作用。这类独特的治疗剂具有针对基因和基因产品的潜力,这些基因和基因产品被认为是其他治疗平台无法用药的。然而,STO必须克服几个细胞外和细胞内的障碍,才能与细胞内的生物RNA靶标相互作用。这些障碍包括细胞外核酸酶的降解,网状内皮系统的清除,肾脏的过滤,穿过毛细血管内皮细胞进入组织间质,细胞表面受体介导的内吞摄取,以及从溶酶体内室逃逸进入其靶标所在的细胞核和/或细胞质。本文综述了近年来该领域的研究进展,重点介绍了反义寡核苷酸(ASO)和小干扰RNA(SiRNA)疗法。
图片来源:https://doi.org/10.1016/j.tips.2021.04.010
Stos代表了制药业继小分子和蛋白质疗法之后的第三个真正的药物发现平台。到目前为止,监管机构已经批准了13种STO,其中100多种正在进行临床评估,适应症从影响少数患者的罕见遗传性疾病到影响数百万患者的心血管疾病,应有尽有。被批准的核酸药物的靶组织涉及多种器官,包括肝脏、中枢神经系统(CNS)和骨骼肌,这些器官在生物学上有很大的不同,而且容易从体循环进入。STO必须穿过至少两层磷脂双层(质膜和内膜)才能到达细胞内的生物受体靶点(RNA和DNA)。考虑到这些药物是多阴离子大分子,穿越这些双层膜是一个难以克服的障碍。事实上,自从这一领域开始以来,关于STO如何完成这一壮举的问题已经引起了几代科学家的兴趣,并向他们提出了挑战。
至少有五大类基于核酸的治疗方法通过不同的分子机制发挥其药理作用:(1)单链反义寡核苷酸(ASO)首先通过WatsonCrick碱基配对与其靶RNA结合。根据所采用的化学设计,ASOS可以通过招募RNaseH1等核酸内切酶来调节剪接,抑制或重定向翻译启动,或促进致病rna的降解。(2)双链siRNA的反义链也通过Watson-Crick碱基配对与其靶mrna结合。如何首先将siRNA装载到核酸内切酶Ago2中,生成程序化RNA诱导沉默复合物(RISC)复合物,促进碱基配对和靶向RNA的降解。(3)与前面描述的RNA靶向机制不同,CRISPR接近靶向基因组DNA。在这种方法中,rna寡核苷酸[单引导(Sg)rna]被加载到内切酶Cas9上,这有助于Watson-Crick碱基与基因组dna配对,随后引入双链dna断裂(Dsb)。由于DSB对基因组的完整性是有害的,细胞已经进化出几种DNA修复机制来逃避DSB的遗传毒性效应。CRISPR/Cas9基因组编辑技术利用了其中的两种机制,即非同源末端连接(NHEJ)和同源定向修复(HDR). (4) 基于信使核糖核酸的方法传递一种化学修饰的信使核糖核酸,该信使核糖核酸被细胞机器翻译以产生所需的蛋白质。(5)最后,带有未甲基化CpG基序的寡核苷酸(ODN)可以通过与细胞表面受体如Toll样受体9(TLR9)或其他核酸感受器相互作用来调节适应性和先天免疫系统。 含有CpG的ODN可以模拟病毒/微生物DNA,通过TLR9和TLR21受体介导的信号级联反应刺激免疫反应。
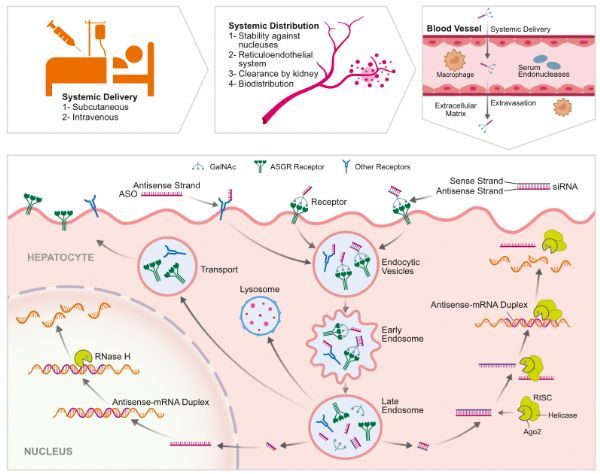
AsO和siRNA可以皮下或静脉给药
图片来源:https://doi.org/10.1016/j.tips.2021.04.010
早期的化学修饰STO依赖于PSoligon核苷酸与血浆和细胞表面蛋白的被动相互作用,以促进全身给药后主要向肝脏和肾脏的递送。PS介导的递送也被成功地用于将Spinraza递送到IT管理后的CNS组织。同样,使用气雾剂将PS-寡核苷酸局部输送到肺部,在临床前动物模型中显示出了早期的前景。使用脂质纳米粒(LNPs)将最小修饰的siRNA有效地运送到肝细胞,将mRNA疫苗运送到免疫细胞,也在临床上得到了证明。PMOs的临床经验表明,如果能安全地在高剂量下使用,细胞穿透特性有限且疗效不高的STO可能会成功。随着GalNAc偶联的siRNA和ASOS对肝细胞的临床成功,受体介导的递送领域本身也见证了复兴。最近关于GLP1R介导的胰腺细胞递送和TfR1介导的骨骼肌组织递送的报道进一步证明,通过受体介导的递送可以有效地将寡核苷酸治疗药物递送到肝外组织。这一领域未来的工作可能集中在加强对感兴趣组织内特定细胞类型的传递,以及穿越受保护的组织屏障,如中枢神经系统(CNS)。药物化学、细胞生物学、受体药理学以及配体鉴定和优化平台的发展将是推动这项技术进入下一阶段发展的必要因素。(生物谷 Bioon.com)
参考资料
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->