2024年7月Cell期刊精华
来源:生物谷原创 2024-07-30 10:23
揭开恐惧记忆背后的主导分子!Cell:颠覆以往认知,大脑中恐惧回路的主要信使分子是神经肽,而并非神经递质、新研究发现一种调节细胞衰老的非编码RNA分子——SNORA13
2024年7月份即将结束,7月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.揭开恐惧记忆背后的主导分子!Cell:颠覆以往认知,大脑中恐惧回路的主要信使分子是神经肽,而并非神经递质
doi:10.1016/j.cell.2024.06.035
当你不经意间碰触到炽热的炒菜锅把手,一股刺痛和警戒的信号立即从你的指尖发出,疾驰穿越脊髓,直达脑干。在这里,一队专门的神经元接过接力棒,将这股疼痛信息传递至大脑深处的一个关键区域——杏仁核。这里是情绪反应的指挥中心,它会激发你对热度的恐惧,让你深刻记住下次远离烫手的锅具。这个将疼痛转化为危险记忆的过程快如闪电,科学家推测,这背后定是某些快速反应的分子——神经递质,在扮演着关键角色。
然而,最新的一项研究颠覆了这一观念,揭示出另一类分子——神经肽,才是这一恐惧记忆路径中的主导信使。这项研究由来自索尔克生物研究所、华盛顿大学和北卡罗来纳大学教堂山分校的研究人员联合完成。相关研究结果于2024年7月22日在线发表在Cell期刊上,论文标题为“Presynaptic sensor and silencer of peptidergic transmission reveal neuropeptides as primary transmitters in pontine fear circuit”。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.06.035
研究通讯作者、索尔克生物研究所副教授Sung Han表示:“关于神经肽,我们还有许多未知领域等待探索,幸运的是,索尔克生物研究所继承了诺贝尔奖得主Roger Guillemin的遗产,他的工作强调了神经肽的重要性,激发了我们的探索欲望。我们创造了两种基因编码工具,用于监测和调控神经末梢释放神经肽。我们坚信,这些新技术将极大地推进神经肽研究领域,而我们对它们在恐惧处理中所扮演角色的认识,仅仅是一个开始。”
为了特异性地定位神经肽,Han和他的团队利用了神经肽与神经递质的一个关键区别:神经递质被封装在小型的突触囊泡中,而神经肽则存储在较大的致密核心大囊泡里。通过设计针对这些致密核心大囊泡的工具,他们创制出神经肽传感器和抑制器。神经肽传感器利用能在神经末梢释放时发光的蛋白质,标记致密核心大囊泡,从而实时捕捉神经肽的释放动态。神经肽抑制器则特异性地破坏致密核心大囊泡内的神经肽,揭示在缺乏神经肽时大脑的反应模式。
研究的第一作者、Han实验室的博士后研究员Dong-Il Kim指出:“我们开创了一种跟踪活体动物大脑中神经肽轨迹与功能的新方法。这些工具将助力我们深化对大脑神经肽网络的理解,开启神经科学领域前所未有的探索篇章。”借助新研发的神经肽传感器和抑制器,以及已有的谷氨酸(大脑中最主要的神经递质)传感器和抑制器,研究者观察了神经肽与谷氨酸在活体小鼠面对轻微刺激(足以激活恐惧回路的刺激)时的行为表现。
他们发现,正是在这一刺激过程中,神经肽得以释放,而谷氨酸却没有。更为关键的是,抑制神经肽的释放明显减少了小鼠的恐惧反应,而抑制谷氨酸却未见相似效果。令Han既惊讶又振奋的是,脑干恐惧回路中的主导信使竟是神经肽,而非谷氨酸。此外,这一发现也强化了他们对PACAP(一种与惊恐障碍相关的神经肽)的现有研究。
2.Cell:新研究发现一种调节细胞衰老的非编码RNA分子——SNORA13
doi:10.1016/j.cell.2024.06.019
衰老是细胞分裂不可逆转的终结。在一项新的研究中,来自德克萨斯大学西南医学中心等研究机构的研究人员发现了细胞调节衰老的一种新方法。这一发现有朝一日可能会为多种衰老相关疾病(包括神经退行性疾病、心血管疾病、糖尿病和癌症)带来新的干预措施,并为一系列称为核糖体病(ribosomopathies)的疾病带来新的疗法。相关研究结果于2024年7月8日在线发表在Cell期刊上,论文标题为“A non-canonical role for a small nucleolar RNA in ribosome biogenesis and senescence”。
论文通讯作者、德克萨斯大学西南医学中心分子生物学教授Joshua Mendell博士说,“人们对减少衰老以延缓或逆转衰老或衰老相关疾病非常感兴趣。我们发现了一种非编码 RNA,当它受到抑制时会强烈影响衰老,这表明它可能成为衰老相关疾病的治疗靶点。”论文第一作者为来自Mendell实验室的应届毕业生Yujing Cheng博士和前博士后研究员Siwen Wang博士。
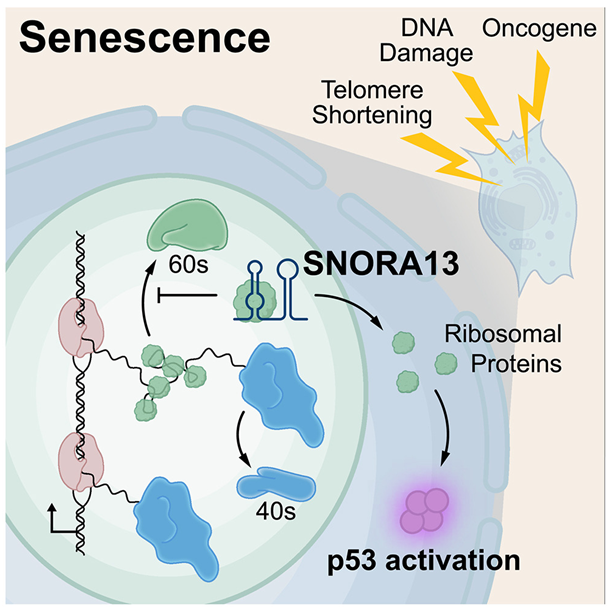
图片来自Cell, 2024, doi:10.1016/j.cell.2024.06.019
长期以来,Mendell实验室一直在研究非编码RNA,发现这些分子在健康和疾病中的新作用。在这项新的研究中,他和他的同事们利用一种名为 CRISPR 干扰的基因活性调节技术,在携带致癌突变的人体细胞中单独使数千种非编码 RNA 失活。通常,这种突变会促使细胞衰老;然而,让一种参与衰老的非编码 RNA 会使细胞继续分裂。
这些实验很快发现了一种以前未被发现的衰老调控因子——SNORA13,它是一种称为小核仁RNA(small nucleolar RNA)的非编码RNA家族的成员,其中小核仁RNA被认为在很大程度上起着引导其他RNA分子进行化学修饰的作用。一系列额外的实验表明,SNORA13 还扮演着另一个意想不到的重要角色:减慢细胞中蛋白合成机器——核糖体的构建速度。
doi:10.1016/j.cell.2024.05.011
在一项新的研究中,来自德克萨斯大学西南医学中心儿童医学中心研究所的研究人员发现癌细胞挽救嘌呤核苷酸(包括我们吃的食物中的嘌呤核苷酸)来促进肿瘤生长,这是一个重要的发现,对癌症治疗有影响。相关研究结果发表在2024年7月11日的Cell期刊上,论文标题为“De novo and salvage purine synthesis pathways across tissues and tumors”。
论文通讯作者、德克萨斯大学西南医学中心儿童医学中心研究所助理教授Gerta Hoxhaj博士和她的团队挑战了一个长期以来的观点,即肿瘤主要是通过从头开始合成嘌呤核苷酸来获得 DNA中的这个细胞生长和功能所必需的组成成分。Hoxhaj实验室的这项新研究表明,肿瘤也明显使用更有效的挽救或回收途径来获取嘌呤核苷酸。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.05.011
Hoxhaj博士说,“70多年来,靶向嘌呤核苷酸的药物一直是癌症治疗的基石,但这些治疗方法有其局限性,而且经常会产生耐药性。我们的研究阐明了从头合成嘌呤核苷酸和嘌呤核苷酸挽救这两种途径的贡献,并强调了这种嘌呤核苷酸挽救途径在肿瘤生长中所起的关键作用,但这一作用以前却被忽视了。”
Hoxhaj博士与论文共同作者Diem Tran博士、Rushendhiran Kesavan博士和Dohun Kim学士利用同位素追踪技术跟踪了正常小鼠组织和多种癌症类型(包括乳腺癌、肾癌、结肠癌和肝癌)中的从头合成嘌呤核苷酸途径和嘌呤核苷酸挽救途径。
正常组织分析表明肾脏挽救的嘌呤核苷酸最多,这可能解释了为什么肾病患者患痛风的风险较高。痛风是一种与尿酸堆积有关的关节炎,可能是由于肾脏无法处理尿酸这种嘌呤核苷酸副产物造成的。
在对肿瘤进行同样的分析时,这些作者发现癌细胞同时使用从头合成嘌呤核苷酸途径和嘌呤核苷酸挽救途径来满足它们对嘌呤核苷酸的持续需求。此外,口服高剂量核苷酸的小鼠肿瘤生长更快,这表明饮食中的嘌呤核苷酸有助于癌症生长。
4.全RNA介导的精准基因写入技术!Cell:我国科学家开创基于逆转录病毒的全RNA介导基因写入技术
doi:10.1016/j.cell.2024.06.020
在一项新的研究中,中国科学院动物研究所研究员李卫(Li Wei)和周琪(Zhou Qi)领导的研究团队,成功开创了一项革命性的基因编辑技术——基于逆转录病毒的全RNA介导的基因写入(gene-writing)技术。这项突破性成果,实现了人体细胞中精准的靶向基因整合,为基因组工程领域带来了前所未有的进展。相关研究结果于2024年7月8日在线发表在Cell期刊上,论文标题为“All-RNA-mediated targeted gene integration in mammalian cells with rationally engineered R2 retrotransposons”。
在这项新的研究中,研究人员通过系统性分析和筛选,确定了源于禽类基因组的 R2Tg 系统在人体细胞中的整合活性,尽管初始效率偏低,但借助多项工程学改良,团队构建了优化版本的R2Tg——en-R2Tg。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.06.020
en-R2Tg基因写入工具通过脂质纳米颗粒(lipid nanoparticle, LNP)(一种用于临床的非病毒载体)递送,在人类肝细胞中的基因整合效率可达25%;在小鼠胚胎中,位点特异性基因整合效率超过了60%。尤为关键的是,en-R2Tg系统在28S rDNA安全港位点,表现出了极高的基因整合特异性,极大地降低了由随机基因整合引发的突变风险。
5.Cell:我国科学家开展的大规模研究揭示了DNA转座子的功能多样性,扩展了基因组工程工具箱
doi:10.1016/j.cell.2024.05.007
在一项新的研究中,中国科学院动物研究所的张勇教授课题组和王皓毅课题组描述了DNA转座子的多样性,并扩展了现有的基因组工程工具箱。相关研究结果发表在2024年7月11日的Cell期刊上,论文标题为“Heterologous survey of 130 DNA transposons in human cells highlights their functional divergence and expands the genome engineering toolbox”。
在这项新的研究中,这些作者从 102 个动物基因组中预测了 130种潜在的活跃 DNA 转座子。通过实验筛选和验证,他们发现了40种在人类细胞中具有活性的新型转座子,使哺乳动物中的活性转座子载体的数量从20种增加到60种,并显著扩大了它们的进化多样性。
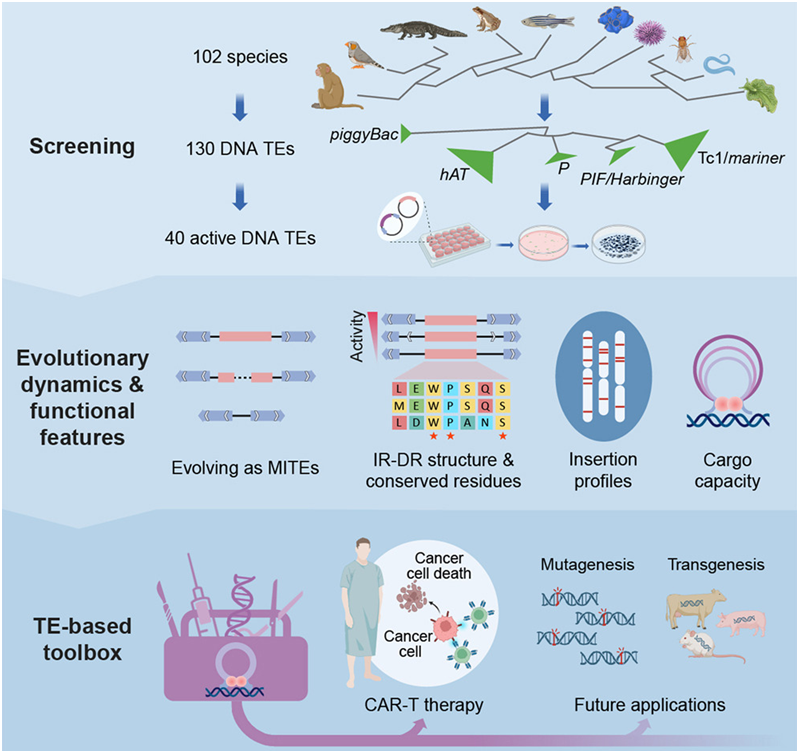
图片来自Cell, 2024, doi:10.1016/j.cell.2024.05.007
利用迄今为止通过系统性实验筛选获得的最大的活性 DNA 转座子数据集,他们进行了进一步的深入分析,破译了转座子活性背后的因素,探索了进化动态,并确定了不同的功能特性。一项值得注意的发现是Tc1/mariner超家族表现出更强的活性,这是它们普遍存在的水平转移的基础。
此外,虽然DNA转座子在以前的应用中可作为基因工程工具用于插入诱变或转基因载体,但只有睡美人(Sleeping Beauty, SB)转座子等少数转座子得到了广泛应用。
这些作者探索了具有不同功能特性的新转座子。其中,最活跃的转座子Mariner2_AG(MAG)在很大程度上优于CAR-T细胞疗法中广泛使用的载体,包括慢病毒和SB转座子,这表明它具有临床应用的潜力。
6.Cell:揭示紫外线辐射损伤导致核糖体停滞,从而引发皮肤细胞较早死亡
doi:10.1016/j.cell.2024.05.018
在一项新的研究中,来自约翰霍普金斯大学医学院的研究人员提出细胞的信使核糖核酸(mRNA)与一种名为ZAK的关键蛋白一起,刺激细胞对紫外线辐射损伤做出最初反应,并在细胞的生死存亡中发挥关键作用。虽然人们早就知道紫外线辐射会损害DNA,但它也会损害mRNA,然而,这项新的研究表明mRNA 是告诉细胞如何应对这一应激的第一反应者。相关研究结果发表在2024年7月11日的Cell期刊上,论文标题为“The ribotoxic stress response drives UV-mediated cell death”。
论文共同通讯作者、约翰霍普金斯大学医学院分子生物学与遗传学系主任Daniel Nathans博士说,“RNA是煤矿中的金丝雀。它在告诉细胞:‘我们这里受到了严重破坏,我们需要做些什么’。”
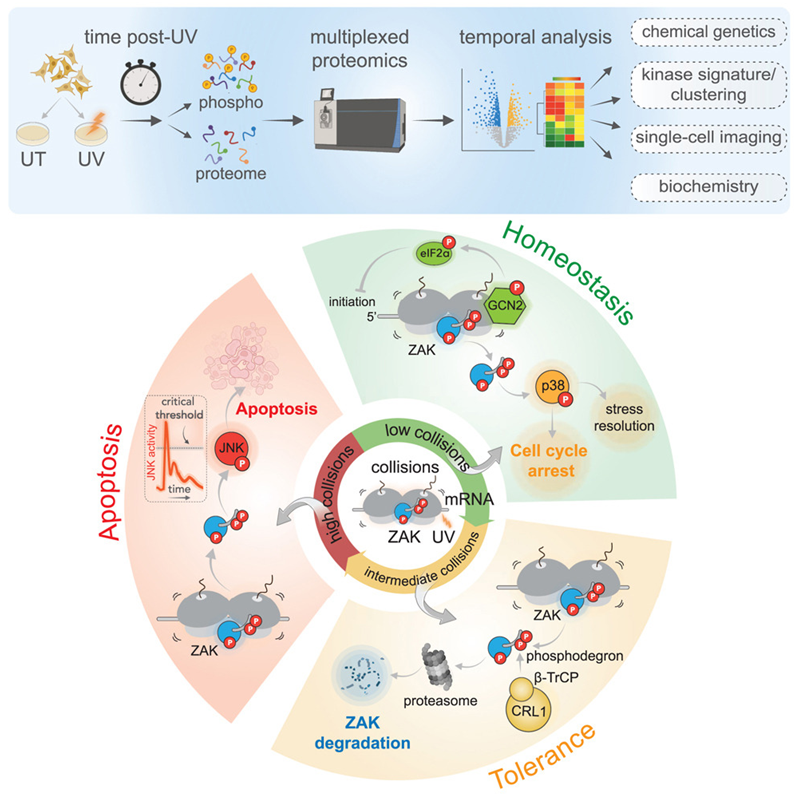
图片来自Cell, 2024, doi:10.1016/j.cell.2024.05.018
在通过感知核糖体碰撞来识别细胞损伤的过程中,ZAK(一种蛋白激酶,属于MAP3K家族,参与细胞应激反应和凋亡途径)发挥着关键作用。核糖体是一种微小的大分子机器,帮助RNA将基因的语言翻译成蛋白的语言。当核糖体沿着受紫外线损伤的 mRNA 运动时,由于无法解码受损信息,导致停滞不前的核糖体被上游核糖体 “追尾”,从而发生碰撞。核糖体碰撞激活了ZAK,它触发了一种称为核糖体毒性应激反应(ribotoxic stress response)的细胞信号传导程序。然后,ZAK引发一系列决定细胞命运的下游事件。
约翰霍普金斯大学医学院博士后Niladri Sinha博士说,更全面地了解细胞在遇到紫外线辐射时如何做出生死攸关的决定,有助于科学家们了解皮肤癌和其他癌症的根本原因。他说,开发靶向核糖体的药物的公司也可能会发现ZAK可能是不同癌症类型中细胞死亡的驱动因素。
7.震惊!这一个基因的缺失会同时导致肥胖和产后抑郁症!Cell:TRPC5基因变异——肥胖症与产后抑郁症背后的隐秘纽带
doi:10.1016/j.cell.2024.06.001
在一项新的研究中,来自贝勒医学院和剑桥大学等研究机构的研究人员发现,人类基因 TRPC5 的改变会导致肥胖症和产后抑郁症。相关研究结果于2024年7月2日在线发表在Cell期刊上,论文标题为“Loss of transient receptor potential channel 5 causes obesity and postpartum depression”。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.06.001
研究团队通过细胞、动物模型及人体的综合考察,发现TRPC5在下丘脑这一关键脑区中扮演着重要角色——其调控着从进食、焦虑,到社交与母性关怀的多重先天行为。
论文共同通讯作者、剑桥大学代谢与医学教授Sadaf Farooqi博士说,“我们对TRPC5在肥胖症和产后抑郁症中作用的研究始于发现两个无血缘关系的男孩的X染色体缺失了一小部分,其中就包括这个基因。这两个男孩有强烈的寻食行为、严重肥胖症和其他行为的异常改变。而他们的母亲都患有肥胖症、焦虑症和产后抑郁症。我们惊异地发现,她们体内的均有一条X染色体中缺少TRPC5基因。”
8.全新人造血管网络开启医疗革命!Cell:运用计算机设计的蛋白,科学家成功在实验室环境下引导人类干细胞分化,催生出全新的血管网络
doi:10.1016/j.cell.2024.05.025
在再生医学领域,一项激动人心的进展正悄然改写未来的医疗版图。华盛顿大学医学院的研究团队,联合多家研究机构,运用计算机设计的蛋白,成功在实验室环境下引导人类干细胞分化,催生出全新的血管网络。这一突破性的成果,不仅为修复受损心脏、肾脏等器官提供了前所未有的希望,更为再生医学的前行之路铺设了坚实的基石。相关研究结果发表在2024年7月11日的Cell期刊上,论文标题为“Modulation of FGF pathway signaling and vascular differentiation using designed oligomeric assemblies”。
论文共同通讯作者、华盛顿大学医学院生物化学教授Hannele Ruohola-Baker说,“无论是心脏病发作、糖尿病,还是自然衰老过程,我们的身体组织都会累积损伤。而修复这些损伤的关键,或许就在于精准调控新血管的形成,从而恢复受损区域的健康血液循环。”

图片来自Cell, 2024, doi:10.1016/j.cell.2024.05.025
生长因子在组织发育、伤口愈合和癌症发展中发挥着关键作用。这些分子通过与细胞外面的受体结合,触发细胞内部的一系列变化。几十年来,科学家们一直试图将天然的生长因子改造为再生药物,虽然取得了一些成功,但是许多实验性疗法都因不精确而成效有限。
论文共同第一作者、华盛顿大学医学院科学家培训计划的应届毕业生Natasha Edman解释说,“我们着手创造定制蛋白,力求与细胞生长因子受体实现高度精确的结合。实验过程中,我们观察到,不同种类的血管发育情况会根据所使用蛋白的不同而有所变化,这标志着我们已经掌握了前所未有的控制力度。”
借助计算机辅助设计,研究团队成功构建了一系列环形蛋白,每一种都能特异性地与多达八种成纤维细胞生长因子受体结合。通过微调蛋白的环状结构及其属性,研究人员得以精准调控干细胞在实验室环境中的成熟进程。最终形成的血管网络不仅功能完备,而且展现出成熟的生理特征:它们能够形成管道结构,具备自我修复能力,还能从周围环境中摄取养分。更令人振奋的是,当这些精细的人造血管网被移植到小鼠体内后,仅三周时间,便成功与宿主的循环系统建立起联系,实现了无缝对接。
9.Cell:独特的三维基因组特征为治疗后窝A组室管膜瘤提供潜在的新靶点
doi:10.1016/j.cell.2024.06.023
后窝A组室管膜瘤(posterior fossa group A ependymoma, PFA室管膜瘤)是一种罕见的、对治疗有耐药性的儿童中枢神经系统肿瘤,起源于大脑和脊髓。由于缺乏有效的治疗方法,它们是复发率最高、预后最差的儿童癌症。
在一项新的研究中,来自贝勒医学院、德克萨斯州儿童医院、卡尔加里大学和麦吉尔大学等研究机构的研究人员确定了PFA室管膜瘤基因组中称为TULIPs的独特三维特征,这些特征最终可能成为开发更有效疗法的靶点。相关研究结果于2024年7月9日在线发表在Cell期刊上,论文标题为“TULIPs decorate the three-dimensional genome of PFA ependymoma”。
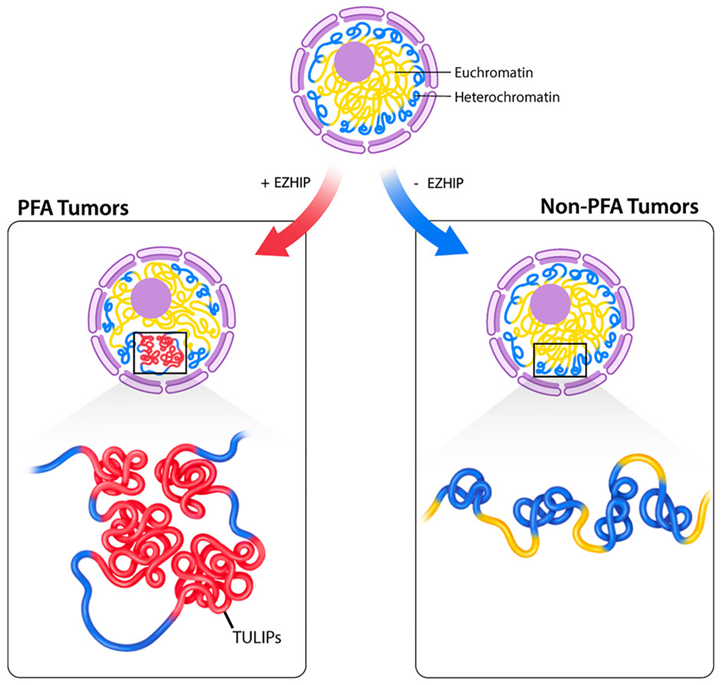
图片来自Cell, 2024, doi:10.1016/j.cell.2024.06.023
论文共同通讯作者、贝勒医学院和德克萨斯州儿童医院的Marco Gallo教授说,“PFA室管膜瘤是致命的。针对这些肿瘤的有效治疗方法研发进展甚微,其原因之一是大多数PFA室管膜瘤缺乏驱动肿瘤生长的明确基因突变。由于没有明确的基因靶点,我们无法设计特定的疗法,因此我们研究了这种肿瘤的另一个方面,即DNA在细胞核内的排列方式。”
论文共同通讯作者、贝勒医学院和德克萨斯州儿童医院的Michael D Taylor教授说,“我们研究了PFA室管膜瘤细胞在三维空间中组织DNA的独特方式,即在通常相距甚远的基因组区域之间协调强烈的相互作用。我们发现了其他类型的小儿脑癌中不存在的特定区域,这些区域在可预测的基因组位置反复出现。我们将它们命名为 TULIPs,即PFA室管膜瘤细胞中的 B 型超长相互作用(Type B Ultra-Long Interactions)。”
这些作者利用Hi-C技术剖析了PFA室管膜瘤整个基因组的三维结构,并将其与来自不同肿瘤类型和非恶性组织的大量样本进行了比较。在这一过程中,TULIPs出现在非常紧密的DNA特定区域,因此难以接近,这表明细胞可能不会经常使用该个区域中的基因。
Gallo教授解释说,“TULIPs还倾向于在很远的距离上相互影响。一个TULIP可能位于染色体的末端,而另一个TULIP可能位于同一染色体的另一端,它们会以惊人的力量找到相互影响的途径。不同染色体上的 TULIPs也能相互聚合并产生强烈的相互作用。我们还发现,TULIPs以外的区域总体上看起来更松弛。这一点非常重要,因为TULIPs与细胞的功能息息相关。”
10.Cell:新研究表明靶向表达protogenin的癌症干细胞样细胞可让第3组髓母细胞瘤萎缩
doi:10.1016/j.cell.2024.06.011
在一项新的研究中,来自贝勒医学院、德克萨斯儿童医院和多伦多病童医院等研究机构的研究人员发现并确定了一个干细胞样细胞(stem-like cell)群体,该细胞群体在发育中的大脑中启动并维持第3组髓母细胞瘤(Group 3 medulloblastoma, Gr3-MB),其中Gr3-MB是儿童脑癌中最具侵袭性的一种,与转移扩散和生存率低有关。相关研究结果于2024年7月5日在线发表在Cell期刊上,论文标题为“Early rhombic lip Protogenin+ve stem cells in a human-specific neurovascular niche initiate and maintain group 3 medulloblastoma”。
这些作者发现,消除Gr3-MB肿瘤中存在的少量干细胞样细胞,可使临床前模型中的肿瘤缩小。虽然还需要开展更多的研究,但这种新方法可能为治疗儿童Gr3-MB患者带来新途径。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.06.011
论文共同通讯作者、贝勒医学院和德克萨斯儿童医院的儿科、血液肿瘤学和神经外科教授Michael D. Taylor博士说,“我们认为,随着Gr3-MB的发育,它保留了胚胎发育时的特征,导致肿瘤快速生长。我们的目标是确定会产生肿瘤的胚胎细胞,以及它们的位置和驱动其生长的因素。”
这些作者将来自六种肿瘤的 Gr3-MB 细胞表达的基因与怀孕头三个月人类胎儿后脑细胞表达的基因进行了比较。论文共同第一作者、Taylor实验室博士后研究员Abhirami Visvanathan博士说,“我们在Gr3-MB肿瘤中发现了胚胎干细胞样细胞(embryonic stem-like cell)谱系的痕迹。这些细胞表达一种叫做protogenin的蛋白,这种蛋白只存在于这些高风险的Gr3-MB中,而在正常的出生后小脑中却不存在。”
这些作者将这些癌症干细胞样细胞(cancer stem-like cell)定位在发育中小脑的一个特定脑区,称为菱唇(rhombic lip)。这些细胞嵌在人类特有的一种称为中间血管丛(interposed vascular plexus)的结构中。当 Gr3-MB 肿瘤发生时,它们会重新形成中间血管丛。其他类型的髓母细胞瘤没有这种独特的血管结构。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


