揪出乳腺癌脑转移帮凶!J Transl Med:外泌体miR-221-3p破血脑屏障促转移
来源:生物谷原创 2025-12-02 10:34
本研究发现,乳腺癌细胞释放的外泌体中,miR-221-3p能精准瞄准脑微血管内皮细胞的白血病抑制因子受体(LIFR),一边激活细胞糖酵解,一边削弱紧密连接蛋白,最终破坏血脑屏障,为乳腺癌脑转移开路。
对乳腺癌患者而言,癌细胞悄悄潜入大脑形成转移灶,是比原发肿瘤更棘手的威胁。一旦发生脑转移,患者不仅治疗选择变少,中位生存期往往只有4到6个月,尤其是三阴性乳腺癌患者,脑转移发生率甚至高达30%至50%。一直以来,医生和研究者都在探寻:癌细胞究竟是如何突破血脑屏障这道防线的?
近日,J Transl Med上的一项研究Tumor exosomal miR-221-3p induces glycolysis through the LIFR/GLUT1 pathway to destroy the cerebral vascular endothelial cell barrier and promote breast cancer brain metastasis,终于揪出了其中的关键帮凶——乳腺癌来源外泌体中的miR-221-3p,为破解这一临床难题提供了新方向。

研究团队首先把目光放在了外泌体上——这种由细胞释放的微小颗粒,就像癌细胞的信使,能携带各种生物分子抵达远处细胞并影响其功能。他们从三种细胞中提取了外泌体:高侵袭性的乳腺癌细胞MDA-MB-231、转移能力弱的乳腺癌细胞MCF-7,以及正常的乳腺上皮细胞MCF10A。经电镜、Western blot等实验验证,这些外泌体不仅有典型的杯状外形,还能检测到CD9、TSG101等外泌体特有的标志物,说明提取的外泌体符合实验标准。
接下来的miRNA测序给出了关键线索:MDA-MB-231来源的外泌体中,miR-221-3p的表达量比其他两种细胞的外泌体高得多。为了确认这个分子和临床的关联,团队分析了患者样本——结果显示,乳腺癌脑转移患者的血清和脑脊液里,miR-221-3p的水平明显高于没有转移的原发性乳腺癌患者;更重要的是,血清中miR-221-3p含量高的患者,生存期也更短。另外,肿瘤细胞本身以及它们分泌的培养基里,miR-221-3p的水平还和肿瘤的转移潜能成正比,这进一步说明它和乳腺癌脑转移关系密切。
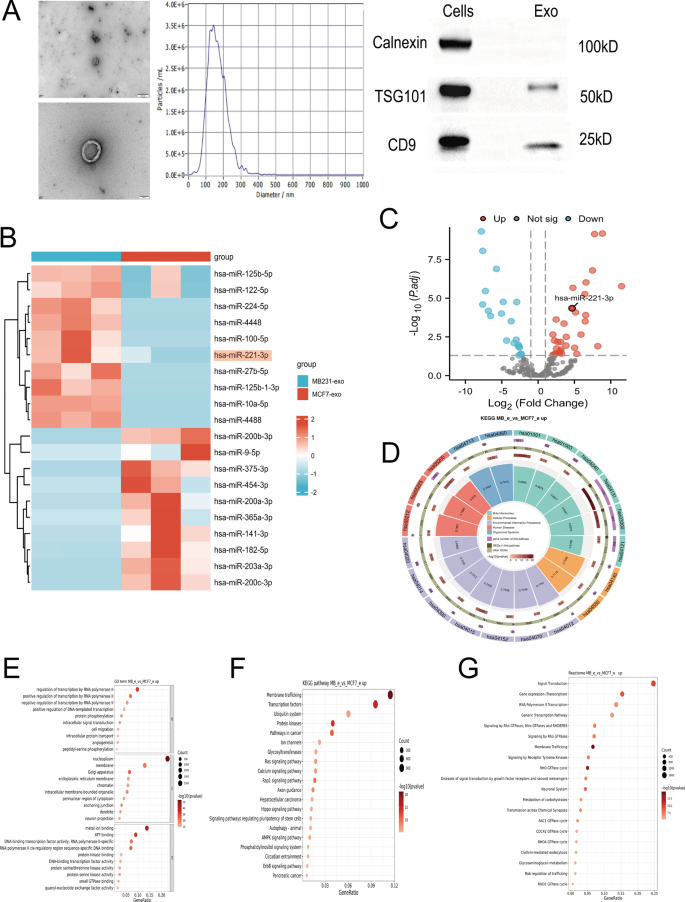
图1:乳腺癌细胞来源外泌体的分离与鉴定
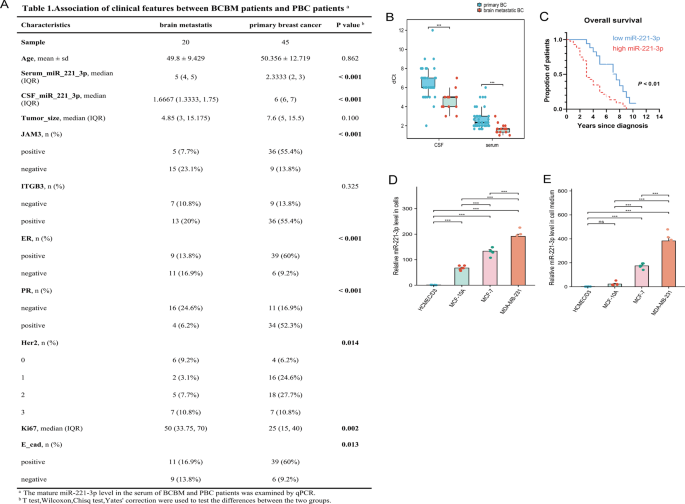
图2:乳腺癌外泌体miR-221-3p水平与乳腺癌脑转移及不良预后相关
那么,这些外泌体里的miR-221-3p,是怎么跑到脑部细胞里发挥作用的?研究团队做了个追踪实验:给MDA-MB-231来源的外泌体贴上荧光标签,再和脑微血管内皮细胞hCMEC/D3一起培养。结果在显微镜下能清楚看到,外泌体被hCMEC/D3细胞吞了进去。之后的检测更证实,hCMEC/D3细胞内miR-221-3p的水平,和释放外泌体的细胞里的水平直接相关;如果让乳腺癌细胞少分泌外泌体,或者用药物阻断miR-221-3p,hCMEC/D3细胞里的miR-221-3p就不会升高。这说明,miR-221-3p正是通过外泌体,从乳腺癌细胞传递到了脑微血管内皮细胞。
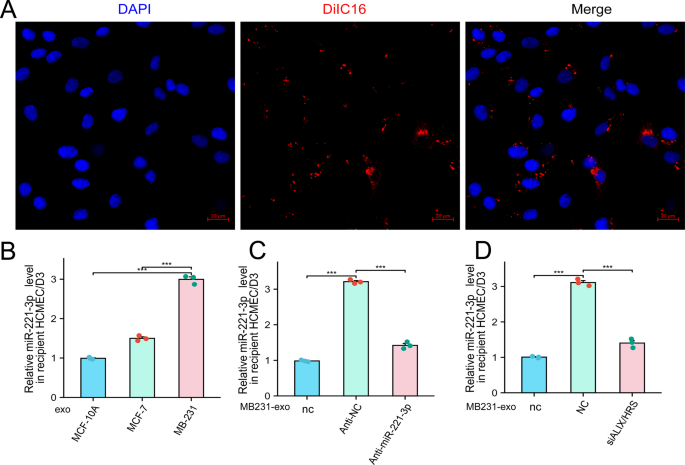
图3:乳腺癌细胞来源的miR-221-3p通过外泌体传递至hCMEC/D3细胞
进入hCMEC/D3细胞后,miR-221-3p又做了什么?研究发现,它首先改变了细胞的能量供应,激活了糖酵解。具体来说,接触了MDA-MB-231外泌体的hCMEC/D3细胞,葡萄糖摄取量、乳酸生成量和ATP产生量都明显上升,而且糖酵解必需的三种关键酶PDK1、PFKL、GLUT1的表达也变多了;反过来,如果用药物拮抗miR-221-3p,这些变化就会消失,糖酵解活性会降下来。除此之外,miR-221-3p还让hCMEC/D3细胞变得更活跃:增殖速度变快、迁移能力变强、更容易形成血管,同时凋亡的细胞变少——这些变化,其实都在为血脑屏障出现漏洞做铺垫。
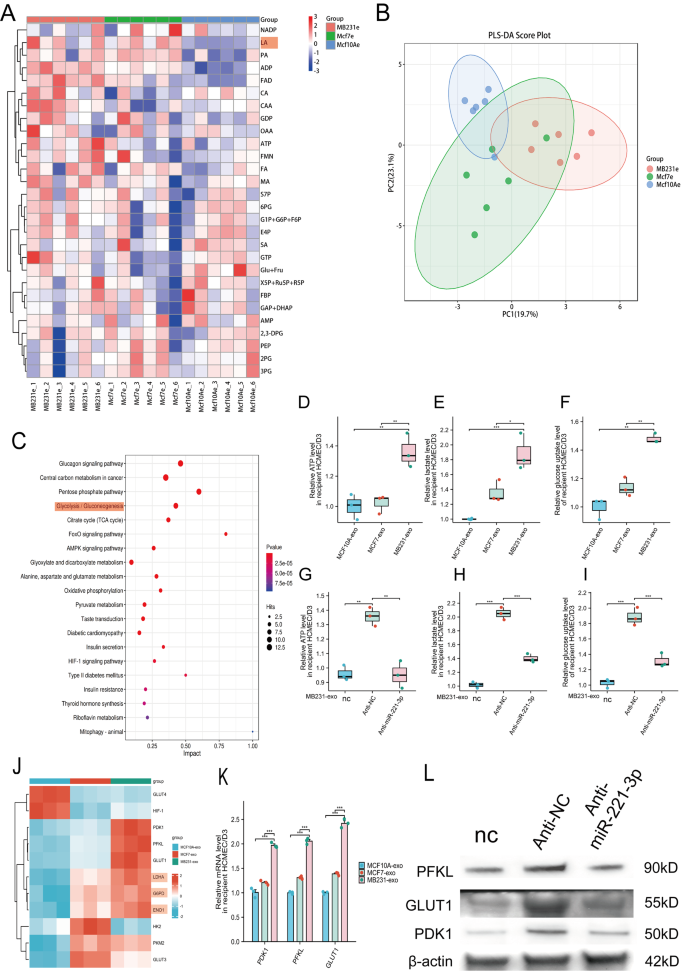
图4:乳腺癌来源的miR-221-3p促进hCMEC/D3细胞的糖酵解
果然,后续实验证实了血脑屏障的漏洞:团队用hCMEC/D3细胞搭建了体外血脑屏障模型,加入MDA-MB-231外泌体后,模型对罗丹明-葡聚糖的通透性明显升高,这意味着屏障漏了;同时,维持屏障紧密性的关键蛋白ZO-1和occludin的表达也降了下来。而如果用药物阻断miR-221-3p,ZO-1和occludin的表达能恢复,屏障通透性会降低,癌细胞穿过屏障的能力也会变弱。
为了找到miR-221-3p的作用靶点,团队通过数据库筛选和实验验证,最终锁定了白血病抑制因子受体(LIFR)。研究发现,在乳腺癌、胃癌等多种癌症中,miR-221-3p的表达和LIFR的表达是反向的;而且miR-221-3p能直接结合到LIFR基因的特定区域,抑制LIFR的表达。更关键的回补实验证明:在阻断了miR-221-3p的hCMEC/D3细胞中,如果再降低LIFR的表达,之前被抑制的糖酵解会重新激活,ZO-1和occludin的表达会再次下降,血脑屏障的通透性和癌细胞的迁移能力也会回到之前的高水平。这说明,miR-221-3p正是通过抑制LIFR,才实现了对血脑屏障和癌细胞转移的调控。
综上,这项研究第一次把乳腺癌外泌体miR-221-3p、LIFR、糖酵解和血脑屏障这几个关键点串联起来,清晰揭示了它促进脑转移的双重机制——既通过改变细胞代谢为转移供能,又破坏屏障为癌细胞开路。这不仅填补了乳腺癌脑转移分子机制研究的空白,更给临床提供了新的治疗方向:未来如果能针对miR-221-3p或者LIFR相关通路开发药物,或许就能堵住癌细胞通往大脑的路,让更多乳腺癌患者远离脑转移的威胁,拥有更长的生存期和更好的生活质量。(生物谷Bioon.com)
参考文献:
Zhu K, Yao H, Hei J, et al. Tumor exosomal miR-221-3p induces glycolysis through the LIFR/GLUT1 pathway to destroy the cerebral vascular endothelial cell barrier and promote breast cancer brain metastasis. J Transl Med. 2025;23(1):1333. Published 2025 Nov 21. doi:10.1186/s12967-025-07372-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


