Cell子刊:宋相容/刘继彦团队开发树突状细胞靶向的mRNA纳米疫苗,增强抗病毒免疫
来源:生物世界 2025-08-28 09:07
这项研究强调了在 mRNA 疫苗开发中精准设计递送系统的关键重要性,为提高疫苗效力、减少脱靶效应以及减轻诸如疫苗相关呼吸系统疾病加重等潜在风险提供了变革性策略。
mRNA 疫苗在疫苗学领域实现了变革性的进步,其生产速度快,且在多种疾病条件下具有强大的免疫原性。合成的类脂质纳米颗粒(LLN)已成为一种用途广泛且高效的递送载体,具有增强的稳定性以及可适应的表面化学特性,能够用于开发高效且低毒性的靶向 mRNA 疫苗。
mRNA 疫苗产生强大且持久的保护性免疫,关键在于抗原呈递细胞(APC),尤其是树突状细胞(DC)能高效呈递抗原,并且这些细胞能最佳地定位到淋巴组织。尽管直接靶向树突状细胞显著提高了疫苗的效果,但在体内疫苗递送过程中,巨噬细胞的非特异性摄取仍是一个重大挑战。尽管巨噬细胞具有吞噬作用,但它们将抗原从外周组织运输到淋巴组织以有效刺激初始 T 细胞的能力有限。因此,减少巨噬细胞介导的纳米疫苗摄取,对于促进淋巴结(LN)运输并最终提高疫苗效力至关重要。
2025 年 8 月 18 日,四川大学宋相容团队、刘继彦团队合作,在 Cell 子刊 Cell Biomaterials 上发表了题为:A precision-engineered dendritic cell-targeted mRNA nanovaccine for enhanced antiviral immunity 的研究论文。
在此,我们开发了一种树突状细胞(DC)靶向的类脂质纳米颗粒(LLN)平台,该平台整合了源自 CD47 的自身肽以减少巨噬细胞吞噬作用,并添加了甘露糖配体以增强树突状细胞摄取。研究结果表明,经过双重修饰的 LLN 显著提高了淋巴结中的 mRNA 表达,促进了树突状细胞成熟,增强了抗原特异性 T 细胞的生成,并引发了强大且持久的抗病毒免疫反应。这些发现强调了配体修饰在 mRNA 疫苗设计中的关键作用,并突显了双重修饰的 LLN 平台作为增强 mRNA 疫苗的有前景的方法。

这项最新研究中,研究团队开发了一种精准设计的类脂质纳米颗粒(LLN)平台,旨在克服 mRNA 疫苗的递送障碍。
该策略结合了两种受体特异性配体:一种源自 CD47 的自身肽(SP),可赋予“别吃我”(don’t-eat-me)信号,有效抑制了巨噬细胞的非特异性吞噬作用;另一种是甘露糖配体,作为“吃我”(eat-me)信号,靶向树突状细胞上的甘露糖受体,以增强树突状细胞摄取。
实验结果显示,这种经过自身肽和甘露糖双重修饰的类脂质纳米颗粒,减少了巨噬细胞的吞噬清除并同时增加树突状细胞的摄取和内化,显著提高了 mRNA 向淋巴结的递送和表达,它还促进了树突状细胞成熟,成功引发了针对 SARS-CoV-2 突变株的强大、持久、以辅助性 T 细胞 1 型(Th1)为主的抗原特异性体液和细胞免疫反应。
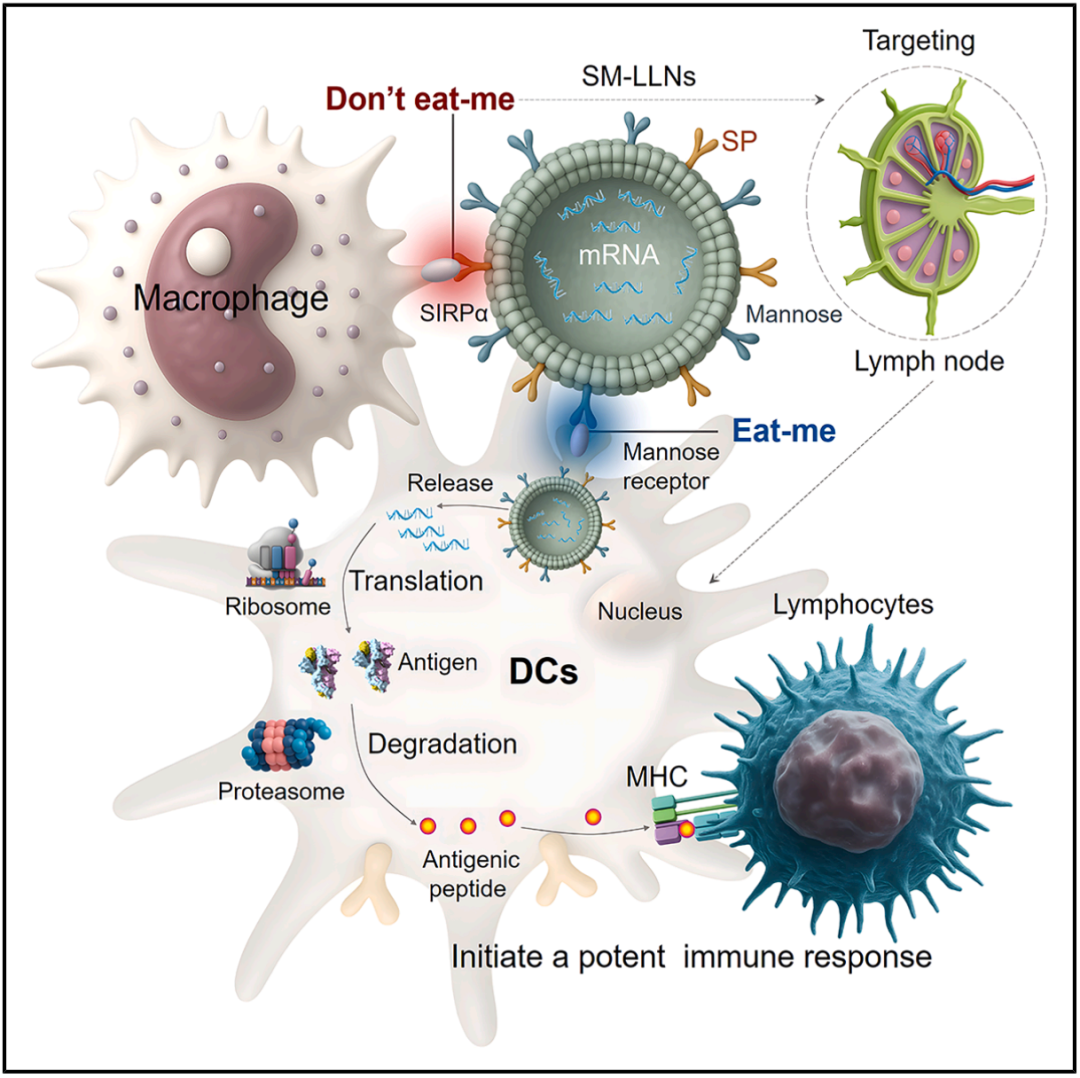
总的来说,这项研究强调了在 mRNA 疫苗开发中精准设计递送系统的关键重要性,为提高疫苗效力、减少脱靶效应以及减轻诸如疫苗相关呼吸系统疾病加重等潜在风险提供了变革性策略。这种精准工程化的类脂质纳米颗粒(LLN)平台为开发针对广泛传染病及其他疾病的下一代 mRNA 疫苗开辟了充满希望的道路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


