CD:科学家找到癌细胞的“崩坏”开关,可成为冷肿瘤加热的关键靶点!
来源:奇点糕 2024-01-17 15:39
简单来说,在内外因素影响和干预,例如表观遗传药物(如阿扎胞苷、地西他滨)的影响下,人体细胞内的内源性反转录转座子可能发生异常转录,产生内源性的DNA或RNA,比较典型的代表就是双链RNA(dsRNA)
近日,Cancer Discovery期刊发表了一项由美国Fox Chase癌症中心研究团队牵头完成的最新研究成果,提出了转化SCLC等冷肿瘤免疫微环境的又一招:借助基于CRISPR技术的筛选,研究发现抑制RNA解旋酶DHX9,可使癌细胞内双链RNA等内源性核酸增多,营造类似病毒感染的状态,从而激活干扰素应答等“内源免疫”机制,成功转变冷肿瘤[1]。

论文首页截图
“营造类似病毒感染的模式”,其实有个更简洁的专业术语——“病毒模拟”(Viral Mimicry),相关机制直到2015年才被较好地阐明。简单来说,在内外因素影响和干预,例如表观遗传药物(如阿扎胞苷、地西他滨)的影响下,人体细胞内的内源性反转录转座子可能发生异常转录,产生内源性的DNA或RNA,比较典型的代表就是双链RNA(dsRNA)。
但在人体细胞内的RNA感受器看来,dsRNA等内源性核酸的出现标志着细胞受到了病毒感染,比如内源性逆转录病毒(ERV)感染就会产生内源性核酸,进而RNA感受器就会激活人体内的抗病毒先天免疫和固有免疫机制,例如对抗病毒、抗肿瘤免疫都非常重要的干扰素应答,肿瘤免疫微环境就有可能借此由冷转热,免疫治疗也可以放手大干一场了[2]。
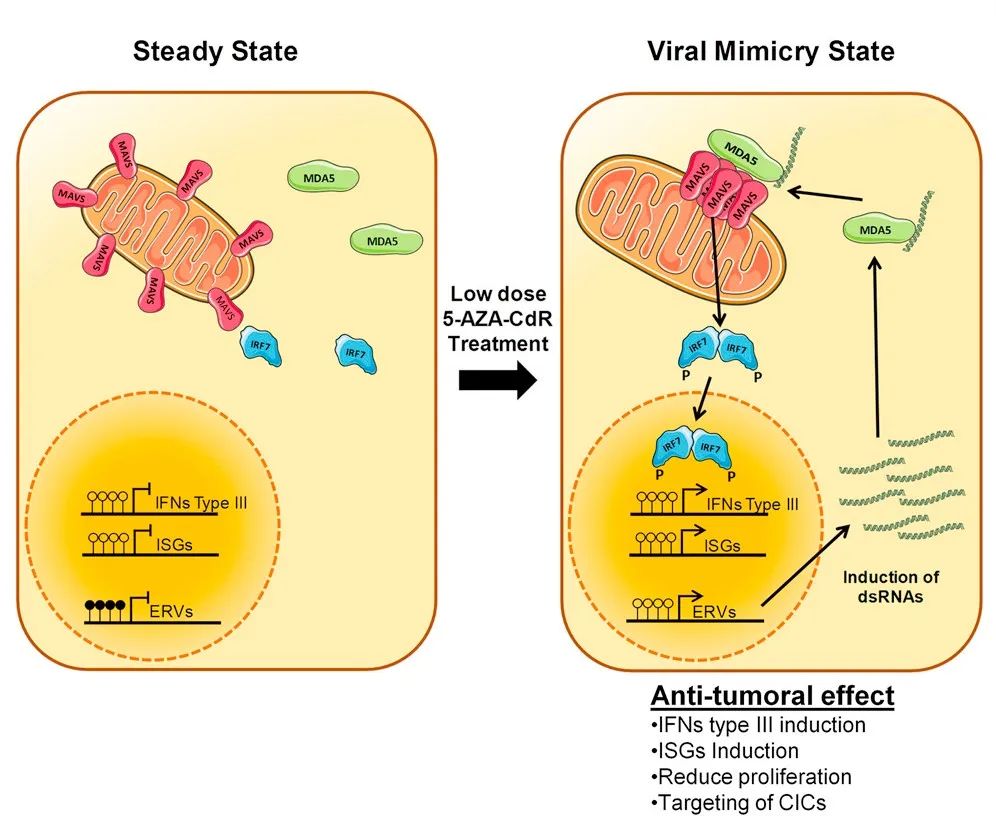
表观遗传药物引发“病毒模拟”现象的机制示意图
(图片来源:Cell)
但在不同的癌症中,激活“病毒模拟”的表观遗传因子并不一致,因此研究者们才需要借助CRISPR技术,把SCLC中的激活开关筛选出来,而筛选重点就放到了RNA解旋酶中,DHX9很快就“脱颖而出”,且研究者们发现SCLC是DHX9表达水平最高的癌症,在绝大多数SCLC细胞系中都可检出DHX9高表达,与患者不良预后相关。
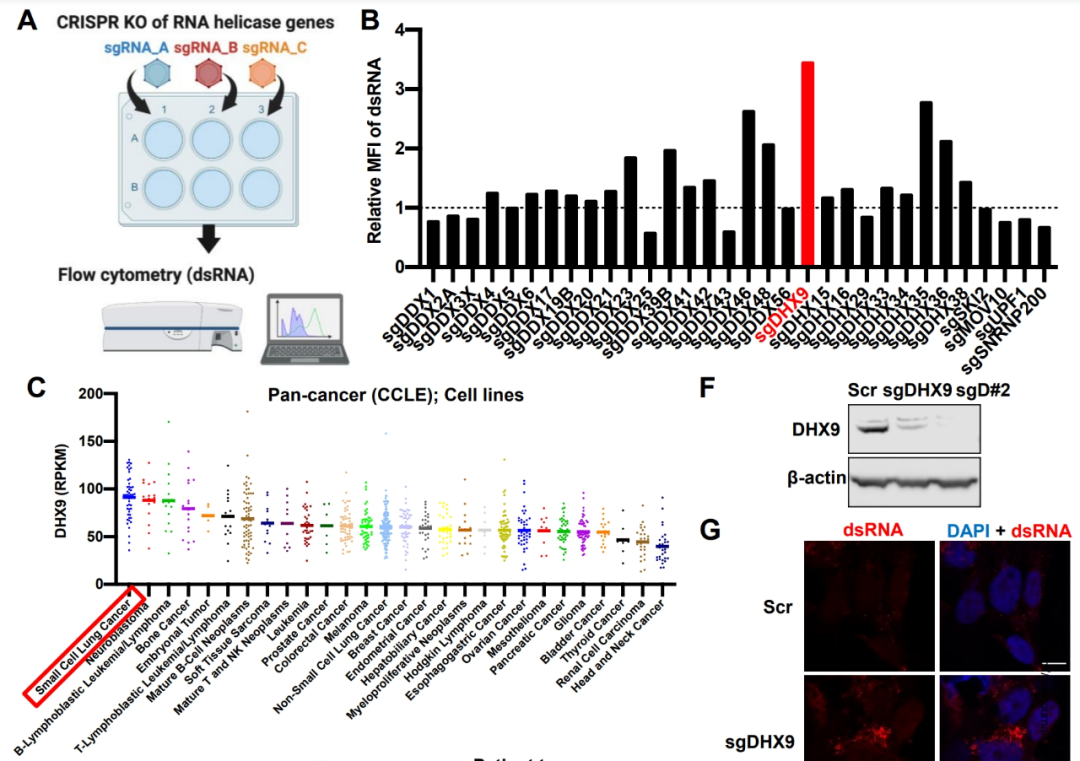
筛选DHX9的过程及其在SCLC中的表达水平
以小向导RNA(sgRNA)敲除SCLC细胞系的DHX9后,研究者们果然观察到了dsRNA的明显积聚;正常情况下,DHX9会将它们有效解旋,防止细胞质内dsRNA水平过高,但敲除DHX9后,就没人来管一管dsRNA了,甚至双链DNA(dsDNA)的积聚也会增多。
进一步实验随即也证实,敲除DHX9足以使众多炎症和免疫应答相关基因的表达上调,其中就有一大批干扰素刺激基因(ISGs),以及多个I型干扰素应答的固有免疫标志物,说明“病毒模拟”这招成了;而且与此同时,研究者们还检测到SCLC细胞MHC-I类分子的表达在敲除DHX9后显著增多,甚至在SCLC中很是少见的PD-L1表达也大幅上调。
而且敲除DHX9还有一些“意外之喜”:鉴于DNA损伤相关基因的表达也有上调,研究者们进一步深挖,发现敲除DHX9还会使所谓“R环”(R-loops),即RNA链与DNA模板链杂交形成的三链核酸不能被解旋、更易积聚在癌细胞内,这既能加剧癌细胞的基因组不稳定性,使癌细胞免疫原性增强,还会激活cGAS-STING通路,这两条都有利于免疫治疗。
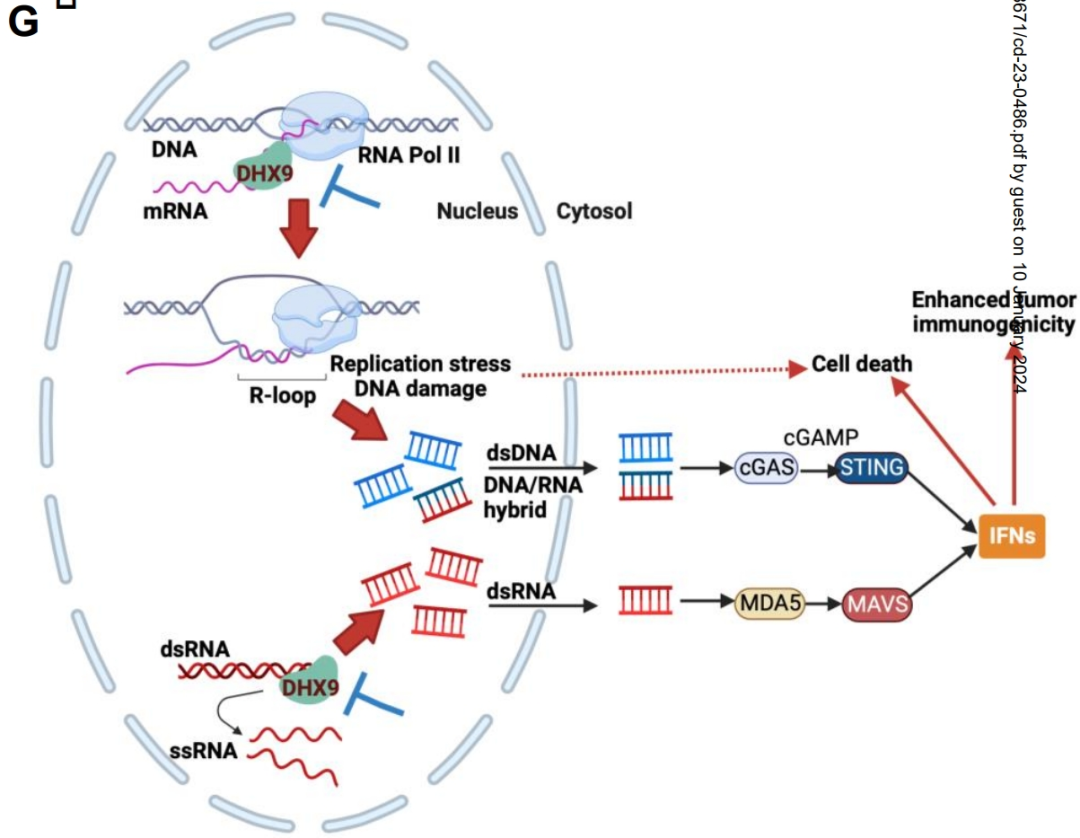
敲除DHX9以增强肿瘤免疫原性的机制总结
最后,研究者们在小鼠实验中成功复现了此前细胞实验部分的结论,即敲除SCLC的DHX9可有效抑制肿瘤生长、诱导更多免疫细胞浸润(如CD8+T细胞)和强有力的抗肿瘤免疫应答,且敲除DHX9也可与免疫检查点抑制剂治疗协同增效;而在人类SCLC患者中,DHX9表达水平与免疫浸润、免疫应答和患者生存预后均呈现负相关性。
研究者们指出,敲除DHX9不仅能通过增加内源性核酸积聚、诱导“病毒模拟”增强抗肿瘤免疫应答,还会增加癌细胞的DNA复制应激,而大多数SCLC细胞又存在TP53或RB1基因失活突变,这会使SCLC对敲除DHX9导致的复制应激更为敏感,敲除DHX9就能由此双管齐下、强力抑癌,至于DHX9在其它实体瘤中作用如何,就要等后续研究来证实啦。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


