高效低温脂肪酶计算设计与理性改造获进展
来源:天津生工所 2025-07-09 13:06
研究揭示了低温脂肪酶的冷适应机制,开展了蛋白的理性改造,实现了低温脂肪酶和中温脂肪酶在宽温域高活性的创制,为其他低温酶的理性设计提供了理论指导。
来源于嗜冷生物的低温酶是自然界中高度进化的酶类之一。通常,在室温及以下温度,低温酶比中温或嗜热同源酶具有更高的催化效率,但对热敏感、易失去活性。因此,在保持低温酶冷适应特性的同时,通过理性设计进一步提高低温酶催化性能、扩大低温酶温度适应范围具有重要意义。然而,揭示低温酶的温度适应性机制仍是酶学研究领域的挑战。
中国科学院天津工业生物技术研究所研究员盛翔带领的研究团队,联合瑞典乌普萨拉大学教授Johan Åqvist团队,以一组序列高度同源、三维结构几乎一致的低温脂肪酶(pLipA)和中温脂肪酶(mLipA)为研究对象,采用经验价键理论/分子动力学模拟等计算模拟与实验验证相结合的方法,探讨了不同温度下两种脂肪酶催化机理,阐明了低温脂肪酶温度、能量与结构之间的关系,确定了活性中心氨基酸残基是pLipA实现冷适应的核心结构因素,并获得了在整个温度范围内的活性均提高的单点突变体mLipA-I12M。
进一步,该研究采用高温下破坏低温脂肪酶非活性状态的构象稳定性策略(通过构建活性中心远端残基的离子相互作用),稳定了催化三联体具有催化活性的构象,构建了pLipA的最适反应温度提高、活性增强的突变体3mut。
上述研究揭示了低温脂肪酶的冷适应机制,开展了蛋白的理性改造,实现了低温脂肪酶和中温脂肪酶在宽温域高活性的创制,为其他低温酶的理性设计提供了理论指导。
相关研究成果发表在ACS Catalysis上。研究工作得到国家重点研发计划等的支持。
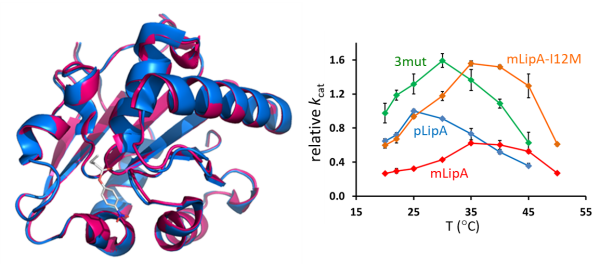
脂肪酶突变体的理性改造
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


