双重磅!西湖大学周强课题组深度解析新型冠状病毒感染人体宿主的奥秘
来源:本站原创 2020-02-23 23:42
2020年2月23日 讯 /生物谷BIOON/ --近日,关于新型冠状病毒(2019-nCoV)的研究成果可谓是层出不穷,这不,来自西湖大学周强课题组的研究人员近日在预印版平台bioRxiv连发两篇文章清楚解析了新型冠状病毒是如何侵袭人体宿主细胞的,相关研究结果或为后期研究人员改进并开发新型治疗药物提供非常有价值的线索和信息。首先,在第一篇题为“Struct
2020年2月23日 讯 /生物谷BIOON/ --近日,关于新型冠状病毒(2019-nCoV)的研究成果可谓是层出不穷,这不,来自西湖大学周强课题组的研究人员近日在预印版平台bioRxiv连发两篇文章清楚解析了新型冠状病毒是如何侵袭人体宿主细胞的,相关研究结果或为后期研究人员改进并开发新型治疗药物提供非常有价值的线索和信息。
首先,在第一篇题为“Structure of dimeric full-length human ACE2 in complex with B0AT1”的研究报告中,研究人员利用冷冻电镜技术成功对2019新冠病毒的受体ACE2的全长结构进行了清楚地解析;血管紧张素转换酶2(ACE2,angiotensin converting enzyme2)是SARS冠状病毒(SARS-CoV)的表面受体,其能直接与刺突糖蛋白(S蛋白)相互作用,ACE2同样也被认为是2019-nCoV的受体;B0AT1(SLC6A19)是一种中性氨基酸转运蛋白,其能在需要ACE2的肠道细胞表面进行表达。

ACE2-B0AT1复合物的整体结构
图片来源:Renhong Yan,et al. bioRxiv (2020) doi:10.1101/2020.02.17.951848
来自美国德克萨斯大学等机构的研究人员通过联合研究利用冷冻电镜技术解析了新型冠状病毒S蛋白的结构,但是ACE2在细胞膜上是以什么状态存在的?2019-nCoV与SARS-CoV 在ACE2结合上又有何异同?揭示ACE2的全长蛋白及其与S蛋白的复合物结构,将有望帮助解答上述疑问。
这项研究中,研究人员展示了人类全长ACE2与B0AT1的复合体在2.9埃分辨率下的冷冻电镜结构,这种复合体能组装形成ACE2-B0AT1异二聚体结构,由于ACE2的肽酶结构域的转移,该复合体能够呈现出开放和封闭的构象。目前关于ACE2的低聚化状态并没有相关报道,研究人员所展示的ACE2-B0AT1复合体结构揭示了其二者之间的二聚体组装模式,B0AT1并不会参与同源二聚化作用,其会与ACE2的颈部区域进行广泛接触,因此,在没有B0AT1的情况下,ACE2或许会以同源二聚体的形式存在,相关研究为揭示2019-nCoV或SARS-CoV的病毒感染分子机制提供了新的线索。
有研究报道,核内体中的组织蛋白酶L能够促进SARS-CoV的S蛋白的裂解,这就揭示了一种受体所介导的细胞内吞作用机制;而ACE2作为二聚体的发现及其与三聚体S蛋白之间同时结合的相容性就表明其之间可能存在一种聚类作用,其或能促进细胞膜的内陷从而用于细胞的内吞作用,研究人员还需要进一步研究来分析ACE2和病毒颗粒之间的相互作用,以及诸如B0AT1等辅因子和整合因子对这一过程的影响效应。
对于膜融合而言,ACE2的C末端片段(尤其是697-716位点的残基)被蛋白酶(比如跨膜蛋白酶丝氨酸2,TMPRSS2)所裂解或能增强S蛋白驱动的病毒入侵过程;在研究者所展示的结构中,他们发现,697-716位点的残基能在颈部区域形成螺旋N3和N4,并映射到ACE2的二聚体界面;B0AT1的存在或许也能够阻断TMPRSS2进入到ACE2的切割位点,ACE2的表达分布要比B0AT1广泛地多,除了能在肾脏和肠道(B0AT1会主要进行表达)中表达外,ACE2还会在肺部和心脏中进行表达,然而B0AT1是否能通过阻断ACE2的裂解来抑制SARS-CoV的感染,后期研究人员还需要进一步深入研究才能得知。
第一篇研究报告中,研究者揭示了在二聚体组装过程中全长ACE2的高分辨率结构,模型研究结果表明,冠状病毒的两个S蛋白三聚体能与一个ACE2二聚体同时结合,本文研究结果为阐明2019-nCoV的感染机制及后期开发新型疗法提供了新的线索和思路。
随后在第二篇题为“Structural basis for the recognition of the 2019-nCoV by human ACE2”的研究报告中,研究人员利用冷冻电镜技术在2.9埃全分辨率条件下,在B0AT1存在的情况下,揭示了人类全长的ACE2受体与2019-nCoV 的S蛋白受体结合结构域(RBD)复合体的精细化结构;研究者表示,与诸如SARS-CoV等其它冠状病毒一样,2019-nCoV能利用S蛋白表面的受体结合结构域(RBD)与宿主细胞的ACE2进行结合。
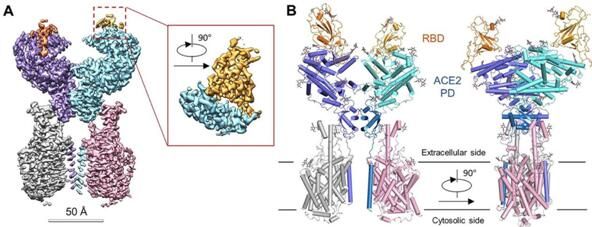
RBD-ACE2-B0AT1复合体的整体结构
图片来源:Renhong Yan,et al. bioRxiv (2020) doi:10.1101/2020.02.19.956946
第一篇研究报告中,研究者揭示了人类全长ACE2与中性氨基酸转运蛋白B0AT1复合体的结构,这篇研究中,研究人员基于此前研究结果,借助冷冻电镜技术深入解析了完整ACE2蛋白与2019-nCoV的RBD的复合物结构。研究者表示,ACE2-RBD界面的局部分辨率为3.5埃,这就能帮助他们分析RBD与受体之间的相互作用,与SARS-CoV一样,2019-nCoV的RBD会被ACE2的胞外肽酶结构域(PD,extracellular peptidase domain)通过极性残基所识别,成对比较后,研究者发现了一些特殊变异,这或许就能够解释上述两种相关病毒的RBDs之间与宿主受体之间不同的亲和性。
在过去两个月里,2019-nCoV因其较高的传染性,所导致的死亡病例数超过了SARS-CoV,但其背后的感染机制研究人员并不清楚,2019-nCoV S蛋白上特殊的成对碱性氨基酸蛋白酶切割位点(furin cleavage site)或许要比SARS-CoV更具传染性,最近研究发现,nCoV-RBD和ACE2之间较高的亲和力或许是一个额外的因素。ACE2与nCoV-RBD和SARS-RBD之间复合体的结构或许就为解析其不同的亲和力奠定了一定的分子基础。
第二篇研究中,研究人员分析了这两种RBD-ACE2之间的界面特性,尽管某些突变会增强nCoV-RBD和ACE2之间的相互作用,但其它变异也可能会降低SARS-RBD与ACE2之间的亲和力;比如,由于ACE2的Lys317和Asp30位点之间盐桥(salt bridge)的形成,因此从氨基酸位点Val404到Lys317的变化可能会导致更紧密连接的形成,将Leu472改变为Phe486可能会增强与Met82之间的范德华力,然而,将Arg426替换为Asn439似乎会通过失去ACE2上的与Asp329形成的重要盐桥而削弱其之间的相互作用。
研究者所揭示的ACE2-RBD复合体结构为开发新型计算和突变分析方法理解亲和力之间的差异提供了新的分子基础,需要指出的是,研究人员或许应该采用其它手段来验证表面等离子体共振技术所测定的亲和力,比如等温滴定量热法(ITC)和微量热泳法(MST)等。阐明nCoV-RBD与ACE2复合体的结构或许也能为后期研究者开发新型病毒检测技术及针对2019-nCoV的潜在治疗手段奠定坚实的基础,基于结构基础设计出的能增强与ACE2或冠状病毒S蛋白亲和力的特殊“粘合剂”或有望帮助开发阻断病毒感染的诱饵配体或中和性抗体。
除了周强课题组这两篇重要研究成果外,近日,来自清华大学和中科院微生物研究所的研究人员也在解析2019-nCoV的S蛋白受体结合结构域与ACE2复合体结构上取得了重大突破,相关的研究结果与周强课题组的电镜结构相互补充和支持。来自中国的这些科学家们在全球范围内首次揭示了新冠病毒S蛋白如何与细胞受体ACE2在原子层面相互作用,值得一提的是,目前研究人员都选择在第一时间将其复合物的原子坐标向全球公布,以提高其潜在的利用价值。相信后期通过科学家们不懈地努力,相关研究结果将能够快速推动新型冠状病毒感染新型药物的研发和疫苗的开发设计。(生物谷Bioon.com)
参考资料:
【1】Renhong Yan, Yuanyuan Zhang, Yaning Li,et al. Structure of dimeric full-length human ACE2 in complex with B0AT1, bioRxiv (2020) doi:10.1101/2020.02.17.951848
【2】Renhong Yan, Yuanyuan Zhang, Yingying Guo, et al. Structural basis for the recognition of the 2019-nCoV by human ACE2,bioRxiv (2020) doi:10.1101/2020.02.19.956946
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


