EMBO J : 周兆才/焦石/安利伟发现辅因子介导的基因转录抑制性相分离现象并研发诱导TEAD4抑制性相分离的抗肿瘤干预策略
来源:生物探索 2024-10-08 09:47
该研究的发现揭示了生物大分子相分离对细胞生长调控的新型模式和分子机制,为靶向相分离的肿瘤治疗提供新思路。
相分离是生物大分子在特定状态下的一种特殊的自发凝聚现象,在基因转录、表观遗传、信号转导等细胞正向生长过程中发挥关键调节作用,但目前对于生物大分子在肿瘤等乏营养背景下相分离现象及其功能作用仍缺乏了解,阻碍了靶向相分离相关的抗肿瘤干预策略的研发。
2024年10月2日,复旦大学周兆才/焦石及同济大学附属第十人民医院安利伟联合团队在EMBO J上发表了文章A cofactor-induced repressive type of transcription factor condensation can be induced by synthetic peptides to suppress tumorigenesis。
该研究首次发现了一种由葡萄糖剥夺引起的与抑制基因转录相关的生物大分子相分离现象,并以Hippo信号通路下游的转录因子TEAD4为例,鉴定了调控其抑制性相分离的辅助因子并解释其对基因转录调控的分子机制,并研发了基于多肽的靶向诱导TEAD4抑制性相分离的抗肿瘤干预策略。

该团队前期系统性地研究了Hippo信号通路的调控网络和分子机制,探究了其在胃肠道肿瘤发生过程中的病理作用,发现了YAP拮抗蛋白VGLL4以及激活蛋白IRF3等调控肿瘤发生发展的功能与机制,并设计发展了靶向抗癌的治疗性多肽及小分子化合物(Cancer Cell 2014/2020; Cell Res 2014; Nat Commun 2017; J Exp Med 2018)。
为了探究乏营养等肿瘤特征对转录因子相分离的调节效应,该团队利用高内涵成像对超过700多个转录因子的文库进行不同条件的系统筛选,发现葡萄糖剥夺可诱导包括TEAD4, EWSH、RFXDC1、GTF2A1L、C16orf5、ZNF800和ELF1等多个转录因子形成生物大分子凝聚体,且这些相分离与转录抑制性表观修饰如H3K27me3存在明显共定位,因此把这一现象命名为转录因子的抑制性相分离现象(Repressive TF condensation)。
在此基础上,该团队以TEAD4为例,发现VGLL4和RFXANK等辅因子可以介导TEAD4的寡聚并促进抑制型相分离生成。与前期已知的YAP/TAZ介导的TEAD4转录激活相分离相比,本研究揭示的TEAD4抑制型相分离可导致DNA/染色质聚集和缠绕从而触发细胞死亡。受此启发,该团队结合前期解析的VGLL4-TEAD4晶体结构,创造性设计了一个模拟VGLL4与TEAD4结合基序衍生肽(GLUP)。体内外实验发现该GLUP多肽能够特异性诱导TEAD4抑制性相分离发生,进而抑制基因转录和细胞生长,在遗传和异种移植胃癌小鼠模型中显示出很强的抗肿瘤作用。
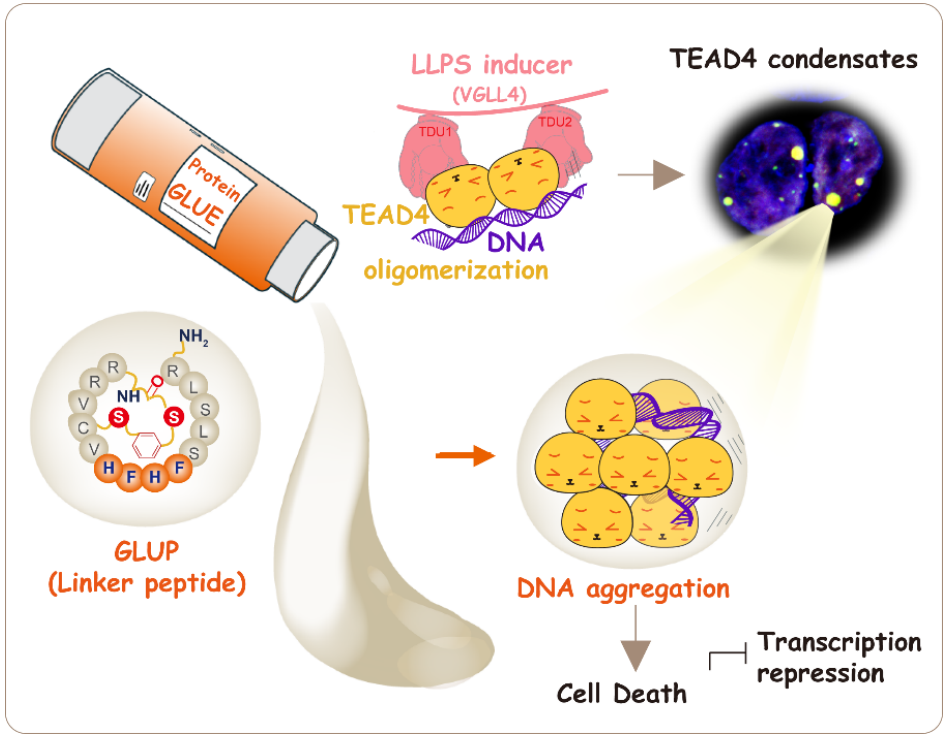
模式图(Credit: EMBO J)
该研究的发现揭示了生物大分子相分离对细胞生长调控的新型模式和分子机制,为靶向相分离的肿瘤治疗提供新思路。同时,这项研究创新性地围绕调控转录因子相分离类型抗肿瘤药物的设计,诱导抑制型相分离,为肿瘤发生的病理机制及靶向干预策略提供了新的策略和先导药物。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


