Cell Metab:mtDNA原核类6mA修饰调控线粒体功能和线虫寿命
来源:生物探索 2024-09-19 09:44
作者通过多种技术手段鉴定到6mA修饰在真核生物线粒体mtDNA中的存在,并且筛选到关键的甲基化和去甲基化酶,6mA修饰调控mtDNA的复制和转录以及突变的跨带传递,最终影响线粒体功能和生物体寿命。
现今,科学界主流观点认为线粒体起源于细胞内共生古细菌,因此线粒体DNA(mtDNA)与核基因组有着截然不同的进化轨迹【1】。mtDNA位于线粒体基质中,通过调控其拷贝数和表达水平来部分调节线粒体功能,这种方式使线粒体能够更好的响应细胞内能量需求和局部压力【2】。mtDNA处于一个氧化压力较大的线粒体微环境中,加之mtDNA不与组蛋白结合,缺乏核基因组的复杂调控网络,mtDNA的复制和转录过程较为宽松【3,4】。核基因组的核苷酸修饰可以丰富DNA编码的信息,使其超出四个典型碱基的范围,并在基因组调控中发挥重要作用。目前,对于mtDNA是否具有功能性的核苷酸修饰仍是一个未有定论的猜想。
近日,来自澳大利亚昆士兰大学的Steven Zuryn在Cell Metabolism上发表了论文Misregulation of mitochondrial 6mA promotes the propagation of mutant mtDNA and causes aging in C. elegans。在本研究中,作者在多种真核生物mtDNA中鉴定到6mA的存在,并揭示了6mA修饰在调控线粒体功能和机体寿命中的关键作用。

5mC修饰是脊椎动物核基因组中的主要表观遗传标记,而6mA在原核生物中更为常见。考虑到mtDNA的起源可能来自古细菌,因此对于mtDNA是否携带6mA修饰仍有争论。为了解决这个问题,研究人员利用多种方法去探究6mA修饰的存在,包括了SMRT-seq、UPLC-MS、MeDIP-qPCR和Dpn I甲基化敏感性检测等。通过这些方法的综合分析,作者在秀丽隐杆线虫的mtDNA中证实了6mA修饰的存在,并且6mA修饰在多个物种中都可能存在。这种修饰在不同物种中的高度保守可能反映了线粒体的原核起源假说。
接下来,研究人员继续寻找介导6mA修饰的候选酶。通过筛选,最终锁定甲基转移酶DAMT-1部分定位于线粒体,特别是线粒体基质和内膜。当DAMT-1缺失时,mtDNA中的6mA水平低于对照组,而将DAMT-1锁定在线粒体中将大幅提高mtDNA的6mA水平。此外,作者还发现SAM合成酶产生的S-腺苷甲硫氨酸对DAMT-1介导的mtDNA 6mA修饰至关重要。另一方面,ALKB-1发挥了6mA去甲基化酶的作用,过表达ALKB-1将降低6mA的水平。
在找到调控线虫6mA修饰的甲基转移酶和去甲基化酶后,研究人员对6mA的生物学功能进行了研究。研究发现,mtDNA的6mA修饰水平异常(无论是升高还是降低)都会显著缩短线虫的寿命,同时6mA修饰还调控了线粒体转录本的丰度,并且在体细胞中限制了mtDNA的拷贝数,6mA修饰的去除会导致mtDNA拷贝数的增加。6mA对mtDNA的这些调控势必会影响线粒体的功能。的确,作者进一步的研究发现,mtDNA 6mA的错误调控会引发线粒体与核基因组亚基之间的失衡,从而导致OXPHOS复合物组装的缺陷。这种缺陷不仅降低了线粒体的氧化磷酸化功能,还通过激活线粒体未折叠蛋白反应(UPRmt)、增加氧化应激水平等机制,引发了与年龄相关的衰退和寿命缩短。
文章的最后,作者探讨了mtDNA的6mA修饰对突变线粒体基因组的多代传播的影响。研究结果表明,mtDNA 6mA去甲基化通过增加mtDNA拷贝数,促进了有害线粒体基因组突变在后代中的传播和累积。这意味着mtDNA的6mA表观遗传状态在跨代的mtDNA突变水平调控中起到了关键作用。由于线粒体DNA通过母系遗传,6mA水平的变化可能对后代的健康和衰老有重要影响,尤其是对于那些携带有害mtDNA突变的个体。
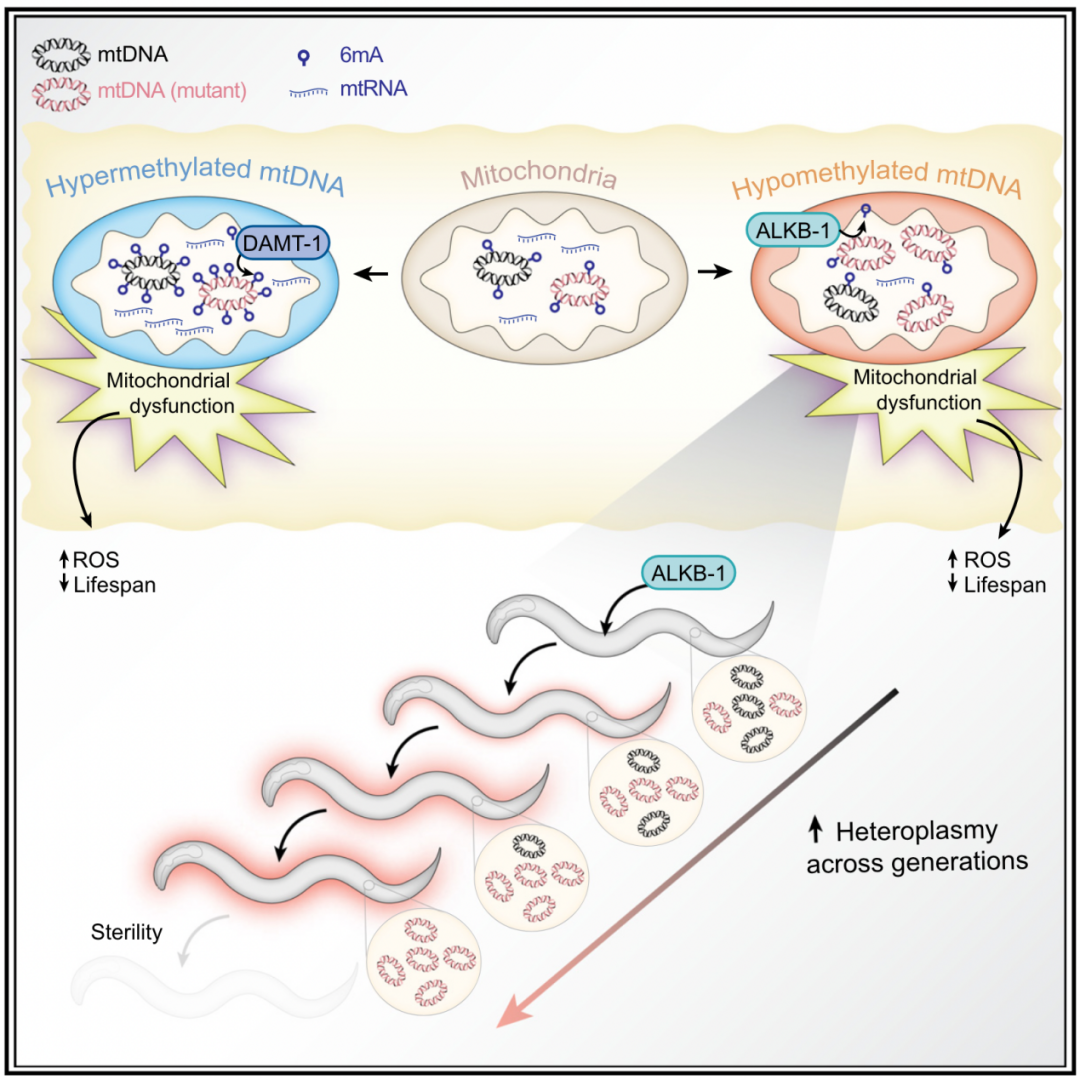
模式图(Credit: Cell Metabolism)
总的来说,作者通过多种技术手段鉴定到6mA修饰在真核生物线粒体mtDNA中的存在,并且筛选到关键的甲基化和去甲基化酶,6mA修饰调控mtDNA的复制和转录以及突变的跨带传递,最终影响线粒体功能和生物体寿命。
参考文献
1. Gray, M.W., Burger, G., and Lang, B.F. (1999). Mitochondrial evolution. Science 283, 1476–1481.
2. Johnston, I.G., and Williams, B.P. (2016). Evolutionary inference across eukaryotes identifies specific pressures favoring mitochondrial gene retention. Cell Syst. 2, 101–111.
3. Chinnery, P.F., and Samuels, D.C. (1999). Relaxed replication of mtDNA: A model with implications for the expression of disease. Am. J. Hum. Genet. 64, 1158–1165.
4. Sastre, J., Pallardo ́ , F.V., and Vin ̃ a, J. (2003). The role of mitochondrial oxidative stress in aging. Free Radic. Biol. Med. 35, 1–8.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


