《自然》杂志刊文:首次揭示决定胰腺癌细胞命运的关键调控因子
来源:中山大学附属医院 2025-10-20 14:51
该研究首次揭示了骨桥蛋白(SPP1)在调控胰腺癌细胞命运中的关键作用,并提出靶向抑制骨桥蛋白以逆转胰腺癌进展的创新治疗策略。
胰腺癌素有“癌王”之称,胰腺导管腺癌是其中最常见、也最致命的一种。一经确诊,患者一年生存率仅约25%,五年生存率更是不足5%,临床治疗手段极其有限。
究竟是什么在背后驱动并维持着胰腺癌细胞的高度恶性?近日,中山大学附属第七医院张常华教授团队与中山大学物理学院物理力学与生物物理研究中心林绍珍教授、英国癌症研究院Axel Behrens院士团队合作,在胰腺导管腺癌研究方面取得突破性进展。该研究首次揭示了骨桥蛋白(SPP1)在调控胰腺癌细胞命运中的关键作用,并提出靶向抑制骨桥蛋白以逆转胰腺癌进展的创新治疗策略。相关研究成果在线发表在《自然》(Nature)杂志上。
胰腺癌治疗之所以难以突破,在于其高度异质性和复杂的肿瘤微环境。胰腺癌中存在着两类细胞亚群:一群是相对“温和”的上皮肿瘤细胞,以及一群更具侵袭性、易转移且高耐药性的间质肿瘤细胞。后者正是导致胰腺癌难治疗和预后极差的主要原因。
早在2022年,张常华教授与Axel Behrens院士团队合作发表在Nature的研究就发现,间质细胞分泌的GREM1蛋白能够维持上皮细胞状态,为解析两类细胞的相互作用提供了首个关键线索。相反,是否存在决定间质细胞命运的关键分泌因子?这一谜题始终悬而未决。解答这一问题,对于彻底理解胰腺导管腺癌中两类细胞的“对话”机制、开发针对间质样肿瘤细胞的精准靶向疗法至关重要。
通过比较早期与晚期胰腺癌患者的血液样本,研究团队发现晚期患者血液中的骨桥蛋白水平显著升高,且其升高程度与肿瘤的上皮-间质转化(EMT)进程密切相关。这表明骨桥蛋白可能与间质细胞的特征维持有关。
随后,研究团队在高度模拟人肿瘤的小鼠胰腺癌类器官模型中,精准“敲除”了负责产生骨桥蛋白的基因。结果令人振奋:一旦骨桥蛋白基因失活,那些凶险的间质性肿瘤细胞便大量消失,类器官在小鼠体内成瘤和转移的能力也显著下降。这表明,骨桥蛋白能够通过影响间质肿瘤细胞的命运,进而调控胰腺癌的进展。
通过深入探索其中的机制,研究团队发现,胰腺癌细胞中的上皮肿瘤细胞和间质肿瘤细胞存在着一种“微妙”的沟通,骨桥蛋白和 Grem1就是两种细胞沟通的关键因子。随后,研究团队精准绘制出了胰腺癌细胞间的对话网络:上皮肿瘤细胞分泌的骨桥蛋白作为关键信使,与间质肿瘤细胞表面的CD61受体结合;这一结合激活了下游信号,促使间质细胞产生更多的BMP2和GREM1蛋白。而GREM1蛋白又会反过来抑制BMP2蛋白,从而帮助上皮细胞维持其特性。至此,SPP1、BMP2和GREM1三者构成了一个精密的反馈调节网络,共同决定着胰腺癌细胞的“双重身份”及其恶性程度。
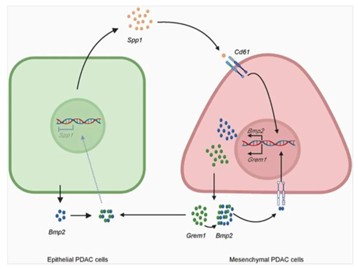
胰腺癌中Spp1、Bmp2和Grem1维持细胞异质性的作用机制模型
最后,研究团队进行了靶向干预的疗效验证。通过使用靶向骨桥蛋白的单克隆抗体药物治疗患病小鼠,治疗组小鼠的寿命显著延长,肿瘤转移也得到有效控制。尤为重要的是,骨桥蛋白是一种分泌到细胞外的蛋白,更容易被抗体药物靶向且潜在副作用较小,这使得靶向骨桥蛋白的策略具有较高的临床转化潜力。
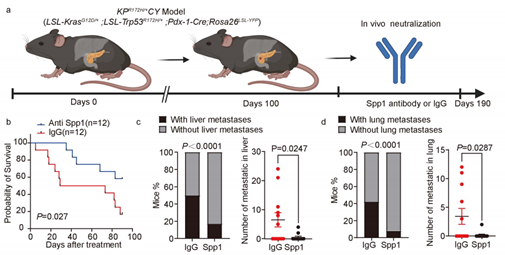
研究团队构建的与人类胰腺癌突变类似的胰腺癌基因工程小鼠模型,图为Spp1中和实验方案示意,经Spp1抗体或IgG对照处理的小鼠生存分析、肝肺转移发生率和数量统计
本研究融合临床医学、生物物理学与分子生物学等多学科优势,突破单一领域认知局限,凭借精巧的实验设计与模型构建,阐明了胰腺癌细胞命运的核心调控机制。研究不仅突破以往仅针对上皮细胞的治疗思路,还为开发靶向肿瘤微环境的胰腺癌精准治疗开辟了新靶点,更为未来开发新型治疗策略提供了重要理论与实验依据。这一成果充分展现了中山大学科研团队在前沿交叉学科领域的创新实力。
英国癌症研究院终身高级科学家(Staff scientist)李华福博士,中山大学附属第七医院蓝林祥研究员和中山大学附属第七医院陈恒星特聘研究员为共同第一作者;张常华教授和Axel Behrens院士为通讯作者。研究得到国家自然科学基金和广东省消化系统恶性肿瘤防治研究重点实验室等基金的资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


