乳腺癌治疗药物变迁:从化疗到ADC
来源:医药魔方 2023-03-03 14:27
乳腺癌治疗药物先后经历了从化疗药物到内分泌疗法和靶向药物的升级迭代,随着免疫疗法的进步,目前形成了包括化疗、内分泌治疗/靶向治疗和免疫治疗在内的多种治疗体系
乳腺癌是目前全球最高发的恶性肿瘤之一,在中国也同样如此,2020年我国乳腺癌新发病例已经高达42万[1]。乳腺癌毫无疑问是一个巨大的公共卫生负担,不过庞大的患者群体同时也吸引了众多制药巨头对此进行布局,投入研发资源,不断丰富治疗乳腺癌的“武器库”。
过去几十年里,乳腺癌领域不断涌现的新药也体现了临床治疗思路的创新,每一次创新也都更进一步地满足了患者的临床需求,进而改变了乳腺癌的治疗实践。我们不妨通过这张时间轴对乳腺癌药物治疗史上的里程碑做一简单回顾。
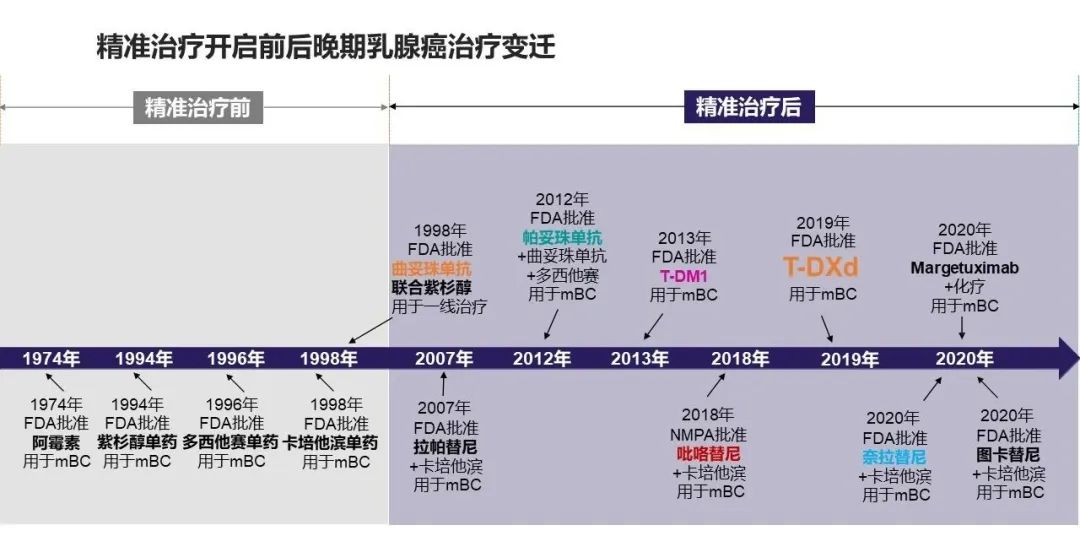
1974年,阿霉素在美国获批用于转移性乳腺癌,标志着以化疗为基石的乳腺癌疗法登上历史舞台。20世纪末本世纪初,以阿那曲唑、来曲唑和氟维司群等药物为代表的内分泌疗法开始崭露头角,标志着乳腺癌治疗进入精准时代。肿瘤驱动因子的发现和相关药物发展,推动了乳腺癌治疗精准靶向时代前进,特别是人表皮生长因子受体-2(HER2)靶点的发现和靶向药物开发,更是将HER2阳性乳腺癌的治疗推进新的时代。
乳腺癌患者中约15-30%属于HER2阳性[2],这部分患者的肿瘤恶性程度较高、侵袭性强且预后不佳。靶向HER2的曲妥珠单抗于1998年面世,成为乳腺癌精准治疗时代的首个靶向治疗药物,也奠定了单抗药物在HER2阳性乳腺癌一线治疗中的基石地位。之后,酪氨酸激酶抑制剂(TKI)类口服小分子、HER2靶向抗体药物偶联物(ADC)恩美曲妥珠单抗(T-DM1)相继上市,补充了HER2阳性乳腺癌二线治疗选择。
近日,阿斯利康和第一三共联合开发和推广的靶向HER2 ADC药物德曲妥珠单抗也在中国获批,进一步丰富了HER2阳性乳腺癌二线治疗的用药选择。
ADC改变乳腺癌治疗药物格局
从化疗、单抗到小分子和ADC,表面上是药物类型的变化、技术的演变,本质上代表了乳腺癌治疗策略的迭代突破。
ADC药物是由抗体、细胞毒性药物及偶联物桥接而成。ADC药物中的抗体起着“导航”的作用,可特异性地识别并引导药物到达病灶,偶联物将在特定的病灶部位发生断裂,释放出具有高效治疗作用的细胞毒素(弹头),最终精准摧毁肿瘤细胞[3]。与传统化疗相比,ADC药物既可以提升肿瘤局部的药物浓度,又可以克服化疗所导致的全身毒性,从而提升全身治疗指数。
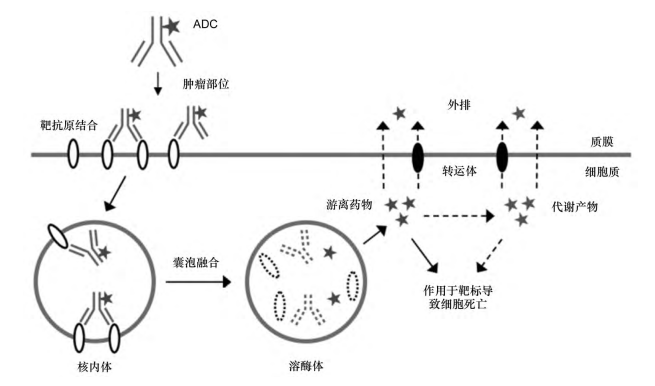
抗体偶联药物作用机制示意图[4]
根据医药魔方数据库,目前国内获批的ADC药物共有7款,其中有3款主要应用于血液瘤,另4款针对实体瘤。2020年1月,中国迎来首款ADC新药恩美曲妥珠单抗。此后,维布妥昔单抗、维迪西妥单抗、奥加伊妥珠单抗、戈沙妥珠单抗、维泊妥珠单抗、德曲妥珠单抗也陆续在国内获批上市,其中恩美曲妥珠单抗和德曲妥珠单抗是获批用于二线治疗HER2阳性乳腺癌。
作为HER2 ADC赛道的后来者,德曲妥珠单抗在之前成功药物的基础上有一些自己的优化改造,实现了创新,也赢得了回报。2022年,恩美曲妥珠单抗和德曲妥珠单抗分别实现了20.80亿瑞士法郎(约22.52亿美元)和1616亿日元(约12.60亿美元)的全球销售收入,不断扩大的ADC药物市场规模也体现了乳腺癌领域的巨大临床需求。
ADC对乳腺癌药物治疗格局的改变不仅在HER2一个靶点上,比如前文提到的戈沙妥珠单抗在人滋养细胞表面糖蛋白抗原2(TROP2)靶点上也实现了三阴性乳腺癌的治疗突破,该药物已被中国临床肿瘤学会(CSCO)在晚期三阴性乳腺癌后线治疗中得到了推荐使用[5]。ADC药物在乳腺癌中的不断突破,意味着乳腺癌治疗探索进入了崭新的阶段,并有望重塑乳腺癌的临床治疗格局。
从小分子到ADC,制药巨头携手
推动乳腺癌临床治疗水平提升
乳腺癌已超越肺癌成为全球发病人数最多的肿瘤。阿斯利康、诺华、罗氏、辉瑞和礼来等深耕肿瘤药业务的制药巨头,都在乳腺癌领域布局开发了多款重磅产品,共同推动了乳腺癌临床治疗水平的提升。
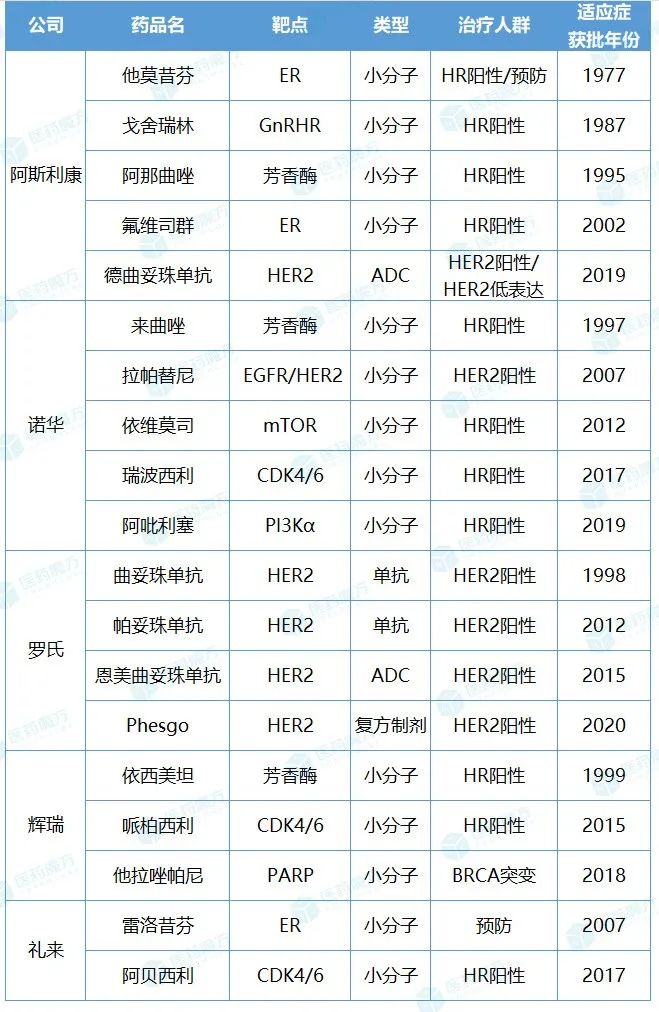
阿斯利康作为乳腺癌领域的先行者,其产品开发思路和业务布局也比较具有代表性和战略意义。早在1977年,阿斯利康就推出了历史上第一个靶向雌激素受体(ER)的药物,率先开启了乳腺癌领域内分泌治疗的时代,之后又相继上市了多款乳腺癌内分泌疗法,治疗人群覆盖从早期到晚期、绝经前到绝经后的激素受体(HR)阳性乳腺癌患者。如今,凭借在ADC领域的开拓,阿斯利康有望重塑HER2阳性乳腺癌治疗格局,进一步奠定其在乳腺癌治疗领域的领导者地位。
诺华主要围绕乳腺癌内分泌治疗建立了较为全面的产品线。首先是芳香酶抑制剂来曲唑获FDA批准上市,作为绝经后HR阳性早期乳腺癌患者的辅助治疗。之后,雷帕霉素靶蛋白(mTOR)抑制剂依维莫司新增乳腺癌适应症。作为诺华旗下的内分泌治疗重磅药物,瑞波西利已凭借出色的市场表现成功迈进“十亿美元俱乐部”。磷酯酰肌醇-3-激酶(PI3K)抑制剂阿吡利塞的上市,填补了PIK3CA突变乳腺癌的治疗空白,也扩大了诺华在乳腺癌领域的布局。
罗氏凭借4款HER2靶向疗法,在HER2阳性乳腺癌领域占据重要地位。曲妥珠单抗揭开了HER2阳性乳腺癌靶向治疗的序幕,并推动了以其为基础的恩美曲妥珠单抗和德曲妥珠单抗等ADC药物的开发。帕妥珠单抗与曲妥珠单抗作用机制互补,两者联用给患者带来更多的生存获益。恩美曲妥珠单抗成功使HER2阳性乳腺癌治疗敲开了ADC的时代大门。
不难看出,各家企业在乳腺癌领域也有着差异化的布局和谋划。诺华和罗氏在HR阳性和HER2阳性乳腺癌领域各具优势,而阿斯利康通过开发多靶点、多技术维度的产品组合实现了HR阳性、HER2阳性和HER2低表达等多个细分领域的全面布局,进一步丰富了广泛乳腺癌患者的临床治疗选择,也为单药疗法、联合疗法和序贯治疗解决乳腺癌全病程临床需求提供了全方位保障。
小结
乳腺癌治疗药物先后经历了从化疗药物到内分泌疗法和靶向药物的升级迭代,随着免疫疗法的进步,目前形成了包括化疗、内分泌治疗/靶向治疗和免疫治疗在内的多种治疗体系,而每一次药物的突破都引领了疾病治疗方式的改变,给患者带来更多的获益。
无可否认,ADC药物成功革新了疾病治疗范式,但也提出了新的临床挑战。如何满足德曲妥珠单抗之后的临床需求变化、如何解决临床耐药问题等,将是需要重新思考的方向。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


