Cell子刊:西湖大学党波波团队开发广谱抑制多种Omicron突变株的强效融合多肽
来源:生物世界 2024-02-12 11:13
该研究建立了一种极大提升HR2肽段病毒抑制活性的新方法,设计构建的A1L35HR2m-Chol能够有效抑制不同SARS-CoV-2突变株、SARS-CoV和MERS-CoV。
西湖大学党波波团队联合香港大学袁硕峰团队,在 Cell 子刊 Cell Reports Medicine 上发表了题为:An enhanced broad-spectrum peptide inhibits Omicron variants in vivo 的研究成果。
该研究报道了一种高效广谱的SARS-CoV-2抑制剂——A1L35HR2m-Chol,能够有效抑制不同的SARS-CoV-2突变株,以及SARS-CoV和MERS-CoV。在预防和治疗实验中,A1L35HR2m-Chol在hACE2转基因小鼠模型中都能够有效抑制多种Omicron突变株的感染和复制。

有研究表明,将靶向SARS-CoV-2病毒刺突蛋白不同位点的配体结合起来可能会产生协同的抑制效果。党波波团队推测来源于ACE2的多肽与RBD结构域结合后可能会破坏病毒刺突蛋白的稳定性,最终导致HR1结构域的暴露。随后,来源于HR2的肽可能会与病毒HR1结构域结合,从而抑制病毒。
基于这一假设,研究团队认为来源于ACE2和HR2结构域的融合肽可能具有协同的抗病毒作用。他们通过柔性连接子(GGGGS0)7将ACE2衍生的A1肽段引入HR2衍生的HR2m肽段中构建A1L35HR2m融合肽。通过实验发现,A1肽段的引入可以增加HR2m自身的螺旋度以及对于靶点HR1肽段的结合亲和力。
此外,研究团队在A1L35HR2m蛋白的C末端修饰上胆固醇生成A1L35HR2m-Chol,显著提高了对冠状病毒的抑制活性,活性提升了约100倍。A1L35HR2m-Chol蛋白在对不同SARS-CoV-2变异株、SARS-CoV和MERS-CoV假病毒的抑制实验中IC50值为0.16-5.5 nM(图1)。
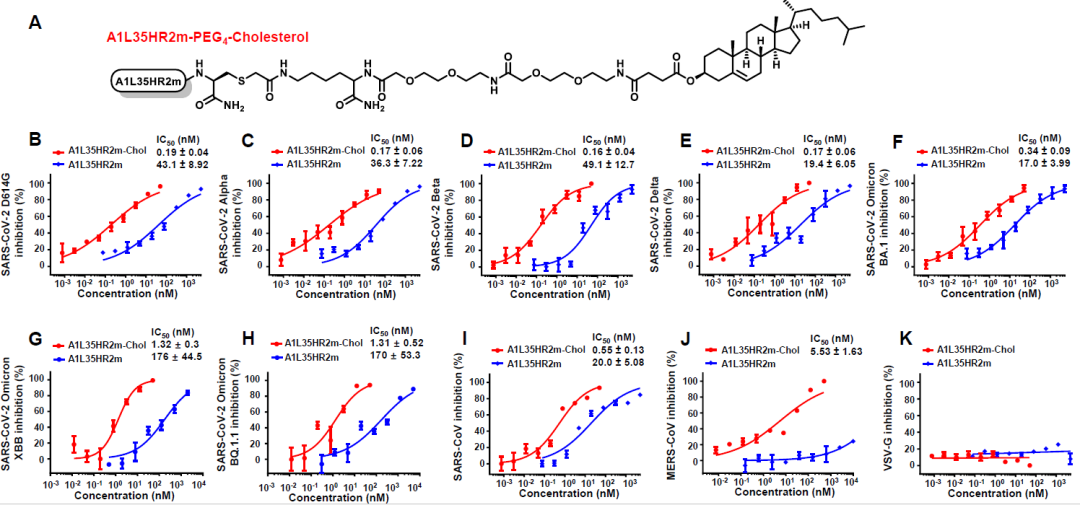
图1. A1L35HR2m-Chol可以广泛而有效地抑制冠状病毒假病毒的感染
研究团队评估了A1L35HR2m-Chol对Omicron BA.2.12.1和BA.5活病毒的抑制活性,在VeroE6-TMPRSS2细胞上进行微中和实验,结果显示,A1L35HR2m-Chol能强力抑制BA.2.12.1和BA.5的复制,其IC50值分别为22.0 nM和23.7 nM(图2A和图2B)。研究团队还在VeroE6-TMPRSS2细胞中进行了Omicron BA.2.12.1和BA.5的病毒载量降低实验,A1L35HR2m-Chol在抑制Omicron BA.2.12.1和BA.5活病毒感染方面效果更加显著,对于BA.2.12.1的IC50值为5.9 nM,对于BA.5的IC50值为10.4 nM(图2C和图2D)。
随后,研究团队使用已建立的K18-hACE2转基因小鼠模型评估了A1L35HR2m-Chol的预防和治疗效果。在预防性研究中,研究团队发现相比于对照组的小鼠,接受A1L35HR2m-Chol治疗的小鼠的肺组织匀浆中的病毒RNA拷贝数量明显减少,鼻甲中的病毒RNA拷贝数量也明显减少(图2F)。此外,在A1L35HR2m-Chol治疗的小鼠中,可传染性病毒滴度显著低于对照组(图2G)。
值得注意的是,接受A1L35HR2m-Chol治疗的小鼠鼻甲中几乎没有可传染性病毒滴度,这表明A1L35HR2m-Chol具有抑制病毒传播的潜力。在治疗性研究中,相比于对照组,接受A1L35HR2m-Chol治疗的小鼠鼻甲中的病毒RNA拷贝数显著减少,而肺组织匀浆中的病毒RNA拷贝数两组之间没有显著差异(图2H)。更重要的是,A1L35HR2m-Chol完全抑制了肺组织匀浆中的可传染性病毒滴度,并没有检测到活的SARS-CoV-2病毒颗粒(图2I)。A1L35HR2m-Chol在预防和治疗模式下对SARS-CoV-2 Omicron BA.5感染均表现出强效的保护作用。
随后,研究团队评估了A1L35HR2m-Chol对K18-hACE2转基因小鼠免受致死性的Alpha突变株感染的效果。结果显示,在预防性研究中,接受A1L35HR2m-Chol治疗的小鼠对致死的Alpha突变株感染表现出完全的保护作用。所有小鼠在研究结束时仍然存活,表现出100%的存活率。对于治疗组的小鼠,它们从第5天开始出现体重损失,并且相比于PBS组的小鼠存活时间更长(图2K和图2L)。
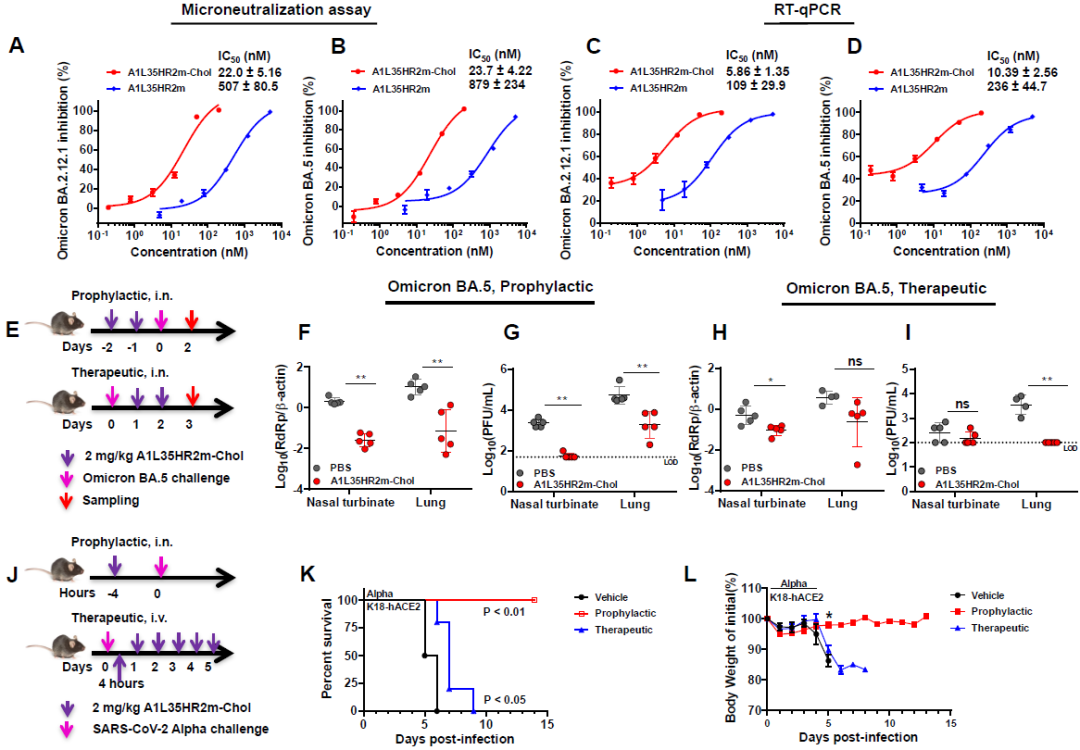
图2. A1L35HR2m-Chol在体外和体内可以有效抑制SARS-CoV-2 Omicron和Alpha突变株
在研究过程中,Omicron EG.5.1成为了主要流行突变株。然后,研究团队评估了A1L35HR2m-Chol对Omicron EG.5.1的抗病毒效果。首先使用VeroE6-TMPRSS2细胞进行微中和实验和病毒载量减少实验。结果显示,A1L35HR2m-Chol可以显著抑制EG.5.1的复制,IC50值为14.4 nM(图3A)。A1L35HR2m-Chol还可以显著减少感染上清液中的病毒载量,IC50值为3.1 nM(图3B)。
接下来,研究团队使用K18-hACE2小鼠模型评估了A1L35HR2m-Chol对EG.5.1的预防和治疗效果。相比于对照组,A1L35HR2m-Chol在预防和治疗组中可以大幅度减少鼻甲中的病毒滴度。值得注意的是,在预防组中5只小鼠中有4只的鼻甲中未检测到病毒滴度,在治疗组5只小鼠中有2只小鼠的鼻甲中未检测到病毒滴度,这表明A1L35HR2m-Chol可以消除这些小鼠上呼吸道中的病毒(图3D)。
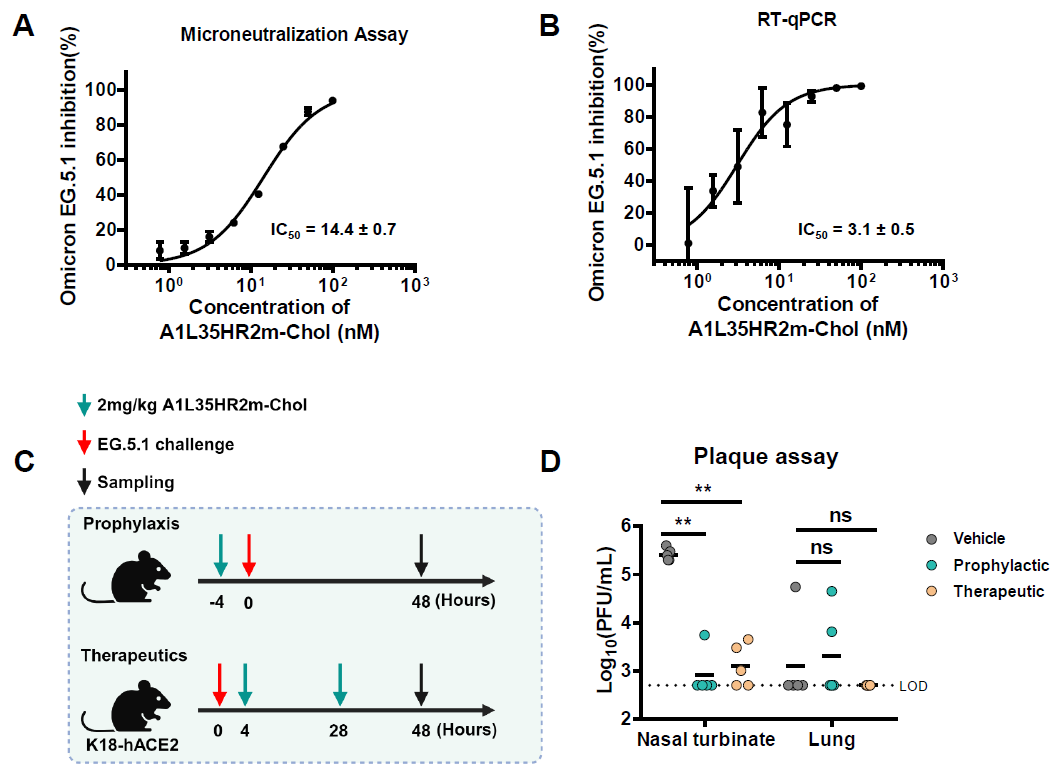
图3. A1L35HR2m-Chol在体外和体内有效抑制Omicron EG.5.1突变株
综上所述,该研究建立了一种极大提升HR2肽段病毒抑制活性的新方法,设计构建的A1L35HR2m-Chol能够有效抑制不同SARS-CoV-2突变株、SARS-CoV和MERS-CoV。相信A1L35HR2m-Chol也很可能保持对未来出现的SARS-CoV-2新突变株的抑制活性。
西湖大学博士后毕稳稳,西湖大学博士研究生陈桂林,香港大学博士研究生唐开铭为该论文共同第一作者,西湖大学党波波研究员,香港大学袁硕峰教授为论文共同通讯作者。该研究受到浙江省重点研发计划,国家自然科学基金,西湖大学及西湖实验室的资助和支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


