《自然·通讯》:中国医学科学院/同济大学科学家发现多粘菌素B抗癌机制,或为肝癌新解
来源:奇点糕 2023-10-30 10:09
SCARB2是维持HCC细胞干细胞样特征的关键,从而在HCC的发生与转移中发挥重要作用。
近日,中国医学科学院医药生物技术研究所的李珂、蒋建东以及同济大学附属东方医院的袁健联手合作完成的最新研究发表在Nature Communications期刊上,揭示了肝癌发生的新机制。
他们发现,SCARB2通过增强MYC蛋白的转录因子活性,来维持HCC细胞的干细胞样特征,驱动HCC发生。使用多黏菌素B可以抑制SCARB2与MYC的相互作用,从而抑制HCC的发生和转移,与小分子靶向药联合治疗小鼠效果更好[1]。

论文首页截图
首先,研究团队利用CRISPR/Cas9文库筛选发现,SCARB2蛋白参与维持HCC细胞干细胞样特征。经体外实验验证,SCARB2被敲除的HCC细胞中CD24、EpCAM、CD13、CD133等肿瘤干细胞标志物水平降低,成球、增殖能力被抑制。
此外,基于人类癌症基因组图谱(TCGA)的分析表明,与正常肝组织相比,各个病理阶段的HCC肿瘤中SCARB2水平都发生上调,与肿瘤干细胞标志物水平呈正相关。而且,SCARB2高表达与HCC患者的短生存期相关。
HCC小鼠模型实验结果则显示,SCARB2缺失表达导致肿瘤大小、肝脏重量、肺结节数量显著降低,小鼠生存时间延长,而且对小分子靶向药物索拉非尼的敏感性提高。在自发HCC小鼠模型中,SCARB2缺失可降低癌症发生率。
这些说明,SCARB2是维持HCC细胞干细胞样特征的关键,从而在HCC的发生与转移中发挥重要作用。
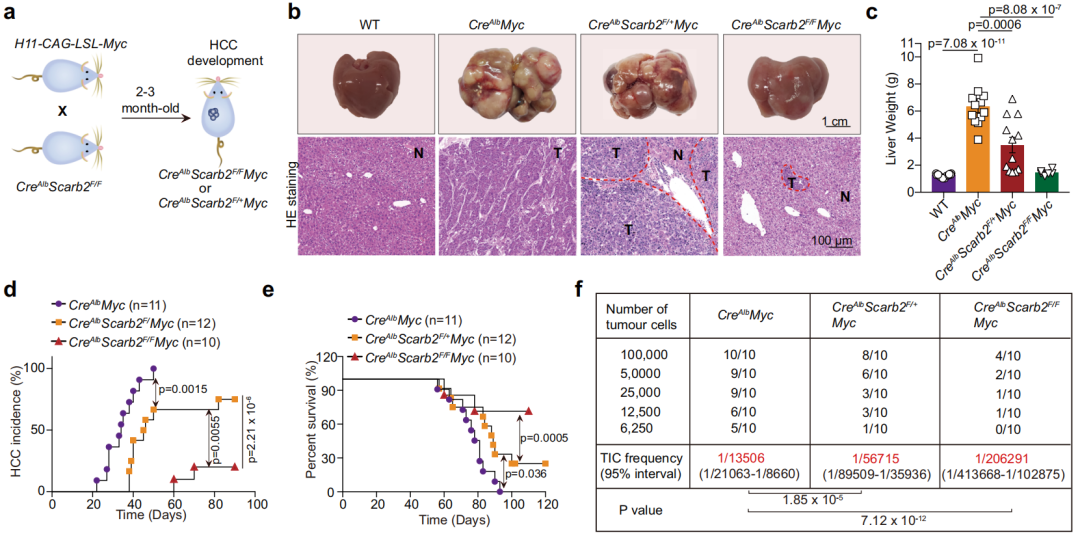
SCARB2缺失减少肿瘤生长和转移
进一步研究发现,SCARB2通过调节MYC蛋白活性来驱动肝癌发生。
具体来看,细胞内的MYC蛋白以转录因子活性调控细胞生长、分化、凋亡,其异常表达是肝细胞重编程转化为肿瘤干细胞的过程中的必要一环。蛋白酶HDAC3与MYC结合后会诱发MYC发生脱乙酰化,下调MYC的活性;而SCARB2能够与HDAC3竞争结合于MYC,进而提高MYC的乙酰化水平,增加MYC转录因子活性。
也就是说,要想破解SCARB2的促癌手法,我们可以避免SCARB2跑去与HDAC3抢夺MYC。
比如,找谁来介入SCARB2与MYC之间的“孽缘”。
研究团队先是描绘出SCARB2与MYC结合的特殊结构域,然后从1317种已经获得FDA批准的药物中筛选,发现多黏菌素B与SCARB2的这个结构域具有高亲和力(KD=0.231μM)。
体外实验结果显示,多黏菌素B的加入确实能够破坏这段感情,凭借与SCARB2的结合高亲和力,抑制HCC细胞内SCARB2和MYC的共定位和相互作用,从而降低MYC的乙酰化水平和活性。与SCARB2敲除的结果一致,多黏菌素B处理能够抑制多种HCC细胞系的干细胞样特征。
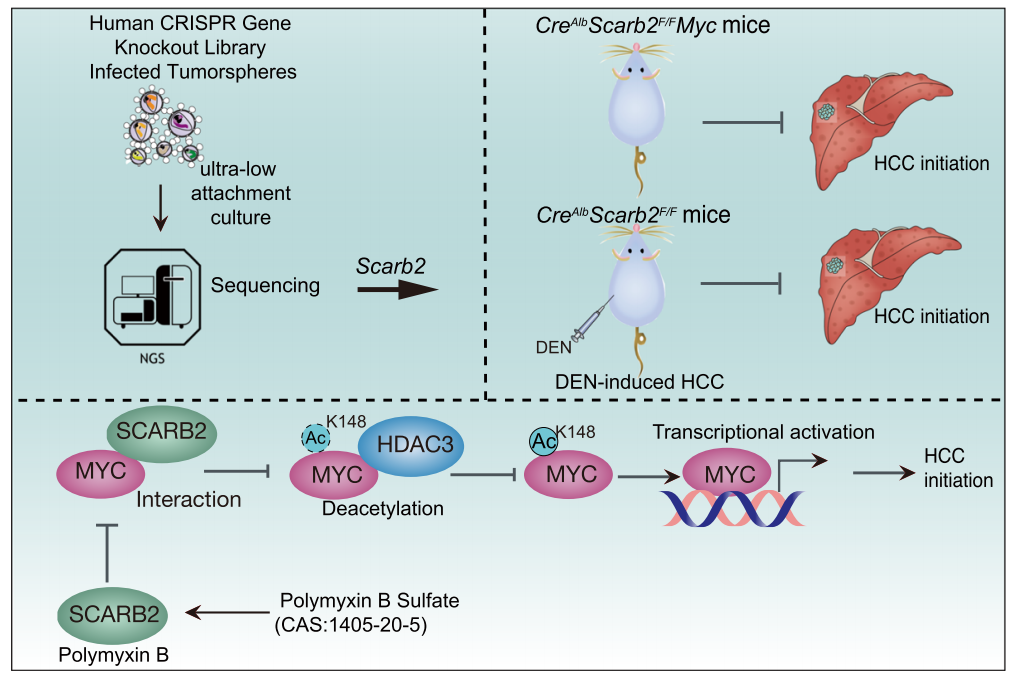
实验设计和机制
在异种移植HCC小鼠模型中,与对照组相比,多黏菌素B单独治疗显著降低瘤内肿瘤干细胞的比率,抑制肿瘤生长和转移。另外,多黏菌素B能够增加小鼠对索拉非尼的敏感性,多黏菌素B+索拉非尼联合使用时治疗效果更为显著。
多黏菌素B治疗没有表现出明显的副作用。相较于对照组,接受多黏菌素B治疗的HCC小鼠总体重和肝脏重量没有差异,血清中血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、胆固醇(CHO)、葡萄糖(GLU)和甘油三酯(TG)水平也没有差异,说明治疗对肝脏功能影响较小。
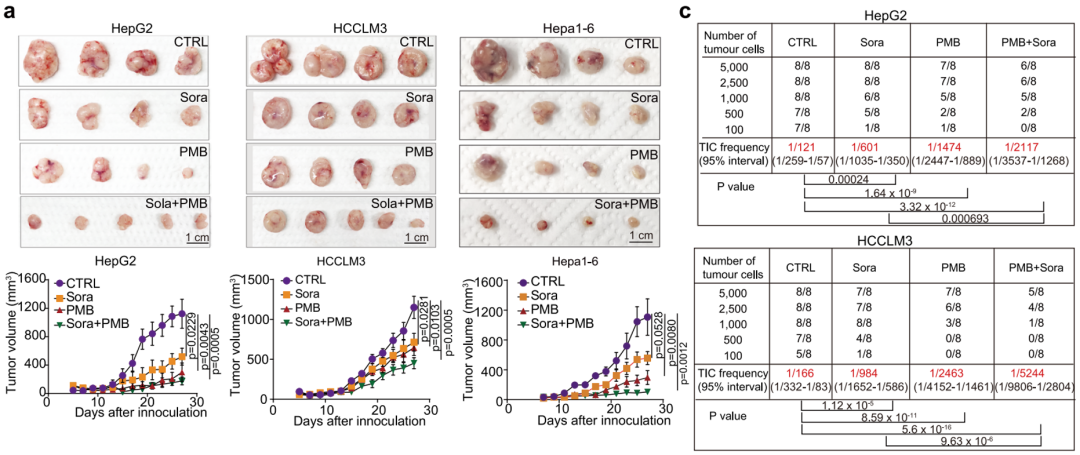
多黏菌素B以及与索拉非尼联合治疗在HCC小鼠中的效果
总而言之,研究团队揭示了肝细胞癌细胞维持干细胞样特性的新机制,并鉴定SCARB2为抑制肿瘤发生和转移的潜在治疗靶点。
多黏菌素B是目前临床上使用的抗生素,迄今为止很少有研究报道其抗肿瘤应用。在这项研究中,小鼠实验结果强调了多黏菌素B用于肝细胞癌治疗的临床转化价值,未来或将进一步探讨多菌霉素B在体内的不良反应。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


