盘点:mRNA疫苗的研究现状、临床应用及市场机遇
来源:生物谷原创 2022-12-27 14:36
mRNA疫苗的研究现状、临床应用及市场机遇
mRNA疫苗的研究现状、临床应用及市场机遇
2022年mRNA疫苗研究方向具有取得了重要的研究从成果,本文中,小编就对本年度mRNA疫苗的研究现状、临床应用及市场机遇等进行整理,分享给大家!
鉴于其卓越的效力、快速的工程设计、低成本的制造和安全的交付前景,信使核糖核酸(mRNA)疫苗提供了一种有趣的替代传统疫苗技术的方法。几个针对传染病和各种癌症的mRNA疫苗平台在体内和体外都显示了有益的结果。与mRNA的稳定性和免疫原性有关的问题已经解决。目前的mRNA疫苗可以产生强大的免疫反应,而不受接受者的主要组织相容性复合体(MHC)单倍型的限制。鉴于基因疫苗是唯一短暂的遗传信息载体,它们也是安全的。
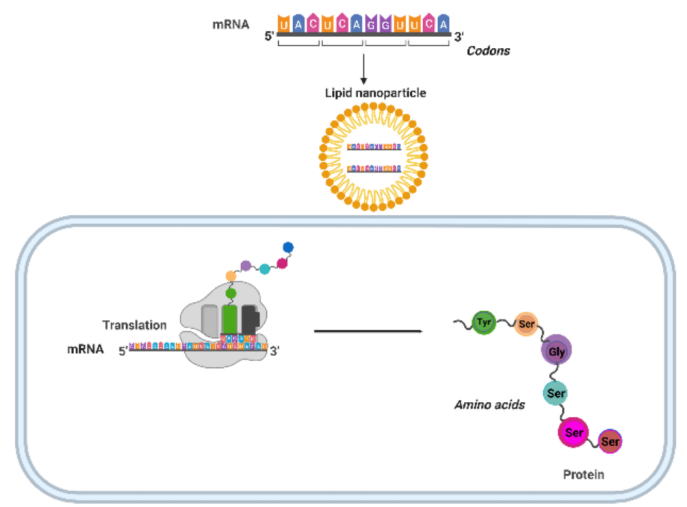
图片来源:10.1016/j.drudis.2022.103458
自20世纪80年代末以来,疫苗诱导宿主免疫反应的能力一直是疫苗研究和开发的核心原则。疫苗需要多糖类抗原(抗原)来诱导天然免疫并提供对感染的保护,而不是依赖于单一的抗原。通过评估疫苗提供的保护水平来降低疾病严重程度和住院率。近年来,基于合成肽、病毒样颗粒、核酸、重组亚单位蛋白和重组病毒颗粒的疫苗研究取得了进展。
一、mRNA疫苗的发展历史
疫苗接种旨在促进对感染病原体和肿瘤细胞的获得性和获得性免疫,从而保护免受病原体和肿瘤细胞的攻击。疫苗介导的获得性免疫在体内既有体液反应,如抗原特异性抗体的产生,作为清除侵袭性感染的第一道防线,也有淋巴细胞(B和T细胞)对抗原或病原体的更持久的细胞介导免疫反应。早期的人类临床试验显示DNA疫苗的效力很差,但改进的递送技术提高了这些疫苗的效力。尽管DNA疫苗和RNA疫苗都提供在宿主细胞中表达的特定重组蛋白,但对mRNA和DNA的利用存在显著差异。首先,单链(Ss)mRNA不如双链(Ds)DNA稳定,因此容易在体内快速降解。然而,mRNA分子可以在宿主细胞的细胞质中直接翻译成蛋白质,而DNA必须被送到细胞核,转录成mRNA,并运输到细胞质进行翻译。设计反式5¢’-甲基葡萄糖苷三磷酸(M7G)帽类似物(M7G),优化3¢’末端的聚(A)尾,以及引入假尿苷等核苷化学修饰,显著提高了转录效率和基因稳定性。此外,为了改善递送和防止在液体和组织中高活性的核糖核酸酶(RNase)对mRNA的降解,已经将mRNA分子包裹在纳米颗粒(NPs)中。
DNA和RNA疫苗可以诱导体液和细胞免疫反应。新出现的病毒疫苗可以快速而容易地开发和修改,以适应突变和新的变异。因此,在严重急性呼吸综合征冠状病毒2(sars-cov-2)的遗传密码被披露仅2个月后,两种基于SARS-COV-2 mRNA的疫苗,mRNA1273和BNT162b2,都是基于脂质的NP配方、核苷修饰的RNA疫苗,进入临床测试,是第一批获得紧急使用授权(EUA)的SARS-COV-2疫苗。然而,RNA疫苗的有效实施受到了限制,因为它们在体内不稳定,而且容易被免疫系统和细胞核酸酶降解,这些问题要求它们在极低的温度(-80摄氏度)下储存和运输。
最近,人们努力优化配方,提供更好的稳定性和延长保质期,以克服这些限制。传统的基因疫苗编码靶基因,其两侧有5’和3’末端非翻译区(UTRs),此外还利用甲型病毒的自扩增RNA(SARNA)开发了基因疫苗。在这种情况下,所传递的mRNA1-4(nsp1-4)包含来自塞姆利基森林病毒(SFV)、辛德比斯病毒(SIN)或委内瑞拉马脑炎病毒(VEE)的非结构基因1-4(nsP1-4),它可以在转基因的宿主细胞中提供20万倍的RNA扩增。这种方法在100-1000倍的剂量下表现出比常规mRNA法更好的免疫应答
1990年,Wolff 等人建立了直接肌肉注射裸质粒DNA用于骨骼肌转基因的方法。尽管最初在20世纪90年代初进行了测试,但由于担心无处不在的RNA引起的不稳定性,RNA疫苗在当时并没有得到广泛应用。因此,大多数基于核酸的疫苗开发的研究都集中在DNA疫苗上,而不是RNA疫苗上。然而,新技术平台的发展证实了RNA疫苗能够诱导强大的体液和细胞免疫反应,这使得基于RNA的疫苗具有吸引力。

图片来源:10.1016/j.drudis.2022.103458
二、 mRNA药物药理研究进展
与基于DNA质粒的疫苗、病毒载体疫苗和传统的减毒活病毒相比,创新的mRNA疫苗有几个显著的好处。与基于DNA的策略相比,基于mRNA的疗法的优点和缺点都有关,似乎有显著的概念性好处。与DNA不同,mRNA不构成染色体整合的潜在危险。治疗性mRNA只产生短暂的表达,并且由于它的SS性质,它在宿主细胞中迅速降解,从安全的角度来看,这可以被视为疫苗开发和癌症治疗的优势。此外,快速引入目标核苷酸序列突变的能力使RNA疫苗非常灵活,这在大流行条件下或个性化治疗中尤其重要。此外,与基于减毒活病毒和病毒载体的疫苗相比,mRNA疫苗是非传染性的,不能整合到宿主基因组中。
对RNA结构的优化进一步提高了RNA的稳定性和翻译能力。例如,在SARS-CoV-2的背景下,将m7GppNmN帽设计到5‘端的工程提高了RNA的稳定性和翻译效率。此外,Poly(A)尾巴和3¢末端非编码区的修饰已被证明有助于改善mRNAs的稳定性和更好的翻译。针对中东呼吸综合征(MERS)冠状病毒S蛋白的受体结合域(RBD)和SARS-CoV-2全长S蛋白或其RBD,通过掺入富GC序列并用1甲基伪尿嘧啶取代尿苷的方法对靶基因的编码区进行了改造,以增强mRNA的翻译。密码子优化,即罕见的密码子被频繁出现的密码子取代,也将翻译效率提高了许多倍。然而,密码子优化也可能影响mRNA的二级结构、翻译动力学和蛋白质折叠,所有这些都可能反过来影响免疫反应的特异性和严重性。
三、 mRNA疫苗的临床应用
mRNA疫苗在感染性疾病中的应用
到目前为止,针对传染病的预防性和治疗性mRNA疫苗已经取得了重大进展,表现出强大的特异性T细胞和体液免疫反应。例如,基于RNA的方法已被开发用于流感病毒疫苗,引起广泛保护性的先天性免疫反应,以抵御同源和异亚型流感病毒的挑战。此外,信使核糖核酸疫苗已经被设计用于兽医,例如在保护小鼠免受口蹄疫病毒(FMDV)挑战的情况下。使用SARNA载体表达狂犬病病毒糖蛋白在免疫小鼠中触发了免疫反应并提供了保护。在另一种方法中,含有POWV(POWV)PrM和E基因的mRNA被包裹在脂质纳米粒中,不仅能诱导针对POWV毒株的强大体液免疫应答,而且还能诱导针对远亲关系的Langat病毒的体液免疫应答。许多动物模型的临床前研究已经证明了用于传染病的mRNA疫苗的可行性,也进行了有限数量的临床试验。
mRNA疫苗在肿瘤中的应用
以mRNA为基础的癌症疫苗是一种独特的方法,它结合了体内生产抗原的潜力和出色的安全性和制造灵活性。表达mRNA的肿瘤相关抗原(TAA)的接种是mRNA疫苗在肿瘤学中最基本的应用。目前已经进行了许多针对mRNA癌症疫苗的临床前研究,一些候选疫苗已经进行了临床试验。临床试验使用了基于TAA的mRNA疫苗,其中树突状细胞(DC)与编码CD70、CD40配体(CD40L)和组成活性TLR4(TriMix)的mRNA电穿孔。接受联合治疗的III或IV期黑色素瘤患者显示出较高的肿瘤反应发生率。活化的TLR4和共刺激分子CD70和CD40L是DC激活和CD8+T细胞应答启动所必需的。为了进一步改变肿瘤微环境(TME),在使用细胞因子混合物刺激DC和T细胞活性后,肿瘤内给药。对IL-23、IL-36和共刺激阻断(OX40L)等细胞因子基因的体外检测可以克服肿瘤抑制环境,产生强大的系统抗癌免疫。不幸的是,目前使用VRP递送的抗原治疗结直肠肿瘤的临床试验仅限于两种(NCT00529984和NCT01890213),而用于癌症疫苗接种的SarNas大多局限于临床前研究。固有的致病相关分子病原体(PAMPs)是限制SARNA使用的关键因素,因为炎症特征的复杂修改可以防止抗肿瘤药物的反复剂量。

mRNA疫苗治疗癌症的临床和临床前实例
图片来源:10.1016/j.drudis.2022.103458
mRNA疫苗在COVID-19中的应用
创新的基于信使核糖核酸的疫苗显示出巨大的前景。虽然传统疫苗技术,如灭活和活减毒病原体和亚单位疫苗接种,可以针对威胁生命的疾病提供长期保护,但要求以低成本和大规模更快地开发疫苗已成为疫苗面临的重要挑战,特别是在大流行的情况下。2019年冠状病毒(新冠肺炎)大流行要求尽快开发针对SARS-CoV-2的疫苗。目前有23种基于RNA的候选疫苗正在临床开发中。
四、 mRNA市场机遇
最近,对mRNA疫苗的临床前和人体研究都出现了热潮,尤其是因为基于mRNA的新冠肺炎疫苗的成功开发。在过去的两年里,大量的临床前和临床数据证明了基于mRNA的技术的有效性。研究表明,mRNA疫苗可以有效地预防一系列传染病,如流感病毒、埃博拉病毒、寨卡病毒、链球菌和寄生原虫弓形虫。此外,针对各种癌症的mRNA疫苗也已开发出来。到目前为止,大多数传染病疫苗都是为了预防而设计的,而大多数癌症疫苗是为了治疗性的。到目前为止,只有两种FDA批准的预防性癌症疫苗获得批准,并用于预防病毒诱导的癌症:乙肝病毒疫苗和人乳头瘤病毒疫苗。肿瘤可以通过细胞毒性T细胞缩小或根除,而细胞毒性T细胞是大多数癌症疫苗的主要靶点。为了开发更有效的癌症疫苗,可以针对在恶性肿瘤细胞中过度表达的TAA。例如,mRNA癌症疫苗可以设计成针对生长相关因子或抗原,这些因子或抗原是由于体细胞突变而对恶性细胞特异的。
三十年的科学和临床进步,再加上研发mRNA新冠肺炎疫苗的巨大努力,预示着mRNA疗法的未来。如上所述,在临床级别,只需点击几下鼠标,就可以自动、可扩展、无细胞地生成编码任何蛋白质的mRNA。在不久的将来,应该有可能产生模块化的、可扩展的良好制造规范(GMP)级制造单元,这些单元可以在任何GMP级设施中建立,从而消除对冷链运输的需求。在这方面,核糖核酸疗法的冷冻干燥即将到来,并将在很大程度上消除目前新冠肺炎核糖核酸疫苗存在的分配问题。随着新的LNP和非LNP载体的开发以及副作用的改善和容量的增加,复杂的基因和碱基编辑以及重复给药可能成为可行的方法,以培育一种新的酶替代治疗方法。
mRNA药物的未来可能取决于以更高的精确度、更长的持续时间和具有可耐受安全性的慢性给药选择,将这种“生命软件”与人类生理系统的生物“硬件”相匹配。在未来几年,mRNA载体、细胞内载体和体内递送系统的快速发展,加上深入的生物学和临床洞察力和直觉,应该会为许多临床需求未得到满足的患者带来新的希望,这些需求无法通过其他治疗方式轻松解决。
参考文献
1. Eduarde Rohner et al. Unlocking the promise of mRNA therapeutics. Nat Biotechnol. 2022 Nov;40(11):1586-1600. doi: 10.1038/s41587-022-01491-z.
2. Alaa A.A. Aljabali et al. Current state of, prospects for, and obstacles to mRNA vaccine development. Drug Discov Today. 2022 Nov 22;103458. doi: 10.1016/j.drudis.2022.103458.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


