科学家如何建立多种模型来助力人类癌症研究?
来源:生物谷原创 2022-09-28 18:00
近年来,科学家们通过建立多种模型在人类癌症研究领域取得了多项重要研究成果,本文中,小编就对相关研究成果进行整理,分享给大家!
近年来,科学家们通过建立多种模型在人类癌症研究领域取得了多项重要研究成果,本文中,小编就对相关研究成果进行整理,分享给大家!
【1】JITC:科学家或有望利用数学模型来解释癌症患者对免疫疗法的反应
doi:10.1136/jitc-2022-005107
能激活免疫系统寻找并杀灭癌细胞的免疫疗法能大大改善很多实体瘤患者的治疗效果,然而,仍然有一部分患者无法从这类疗法中获益,目前并没有免疫生物标志物能解释有类似疾病和疾病特征的患者为何会出现不同的治疗结果,近日,一篇发表在国际杂志Journal for ImmunoTherapy of Cancer上题为“Rethinking the immunotherapy numbers game”的研究报告中,来自Moffitt癌症研究中心等机构的科学家们通过研究揭示了如何利用数学模型来分析不同癌症疗法对肿瘤和免疫细胞动态学变化的影响,同时还能帮助预测个体化癌症疗法的治疗结果。
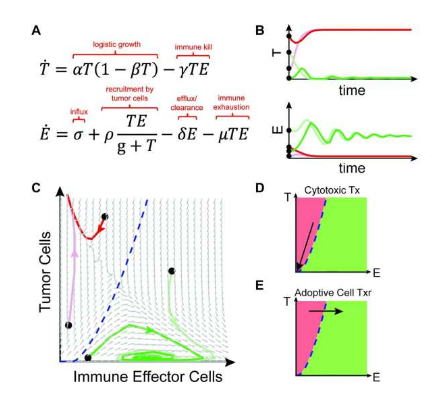
科学家或有望利用数学模型来解释患者对免疫疗法的反应。
图片来源:Journal for ImmunoTherapy of Cancer (2022). DOI: 10.1136/jitc-2022-005107
众所周知,癌细胞群和周围免疫环境之间的相互作用或会影响癌症的发生和进展,以及患者对免疫疗法的反应,有些患者对免疫疗法的反应很好,而其它患者则不然,目前研究人员并不清楚这些患者之间的差异。研究者Rebecca Bekker说道,就好像早期癌症和晚期疾病的治疗方式不同一样,免疫参与程度不同的肿瘤或许需要非常不同的治疗手段。
为此,研究人员就想通过研究来改善对肿瘤和免疫细胞相互作用的理解,从而帮助预测患者的治疗结局并识别出最佳的治疗手段,知晓这些动态学变化非常复杂,且难以在实验室环境下进行研究,研究人员采用了另外一种方法,借助数学建模来对这些相互作用进行概念化分析,他们开发了一种新型模型来模拟随着时间延续肿瘤细胞和免疫细胞组合之间所有可能的相互作用,其中包括肿瘤生长和消除的速率,以及免疫细胞招募和耗竭的相关参数等,这种模型最后的结果要么是出现免疫逃逸(即肿瘤细胞增长到其最大潜力),要么就是通过免疫细胞的抗肿瘤活性来控制肿瘤。
【2】Mol Cancer:一种新型模型或能帮助检测并抵御人类肺癌的复发
doi:10.1186/s12943-022-01553-5
非小细胞肺癌(NSCLC)是一种毁灭性的疾病,也是引发美国癌症患者死亡的主要原因,即使适合肿瘤切除治疗的患者也有50%的死亡率,近日,一篇发表在国际杂志Molecular Cancer上题为“Tumorigenic circulating tumor cells from xenograft mouse models of non-metastatic NSCLC patients reveal distinct single cell heterogeneity and drug responses”的研究报告中,来自密苏里大学医学院等机构的科学家们通过研究识别出了一种研究循环肿瘤细胞活动和易感性的过程,循环肿瘤细胞主要与NSCLC患者机体的癌症复发密切相关。
这项研究中,研究人员从10名人类NSCLC患者机体中提取了肿瘤碎片,并将其注射到免疫缺陷小鼠体内,随后识别来自这些小鼠机体中的循环肿瘤细胞,并对其分离,然后作为液体活检样本注射到另一组小鼠体内,从而制成所要研究的模型,研究人员想观察10份患者样本中的两份样本中的循环肿瘤细胞转变为小鼠模型机体中的稳定肿瘤组织。
医学博士Jussuf Kaifi说道,这些循环肿瘤细胞具有增强的转移潜能,而这些研究模型也显示出,这些细胞簇与癌症复发之间存在一定的关联,这些研究发现表明,液体活检模型或许有望作为一种非常有价值的工具来帮助研究并预测个别患者在局部肺癌组织被切除后未来疾病复发和转移的风险或可能性。
此外,研究人员还检测了这些肿瘤细胞对化疗的耐受性,结果发现了一种名为MYC的蛋白编码基因,其或许主要负责肿瘤对常见化疗作用的耐受性,通过阻断小鼠模型中的MYC的功能,研究人员发现,肿瘤细胞或许对化疗疗法变得非常易感。研究者Kaifi说道,肺癌患者机体肿瘤所衍生的小鼠模型或许能作为非常宝贵的药物敏感性检测平台,或许是患者出现疾病不可治愈复发之前的一个时间窗口。
【3】Science:构建渐进式基因组编辑的人类黑色素瘤模型,揭示突变对肿瘤和微环境的影响
doi:10.1126/science.abi8175
癌症的发生是由于多个基因的突变使原本正常的细胞发生癌变,而且这些突变通常是长期积累的,在患者的肿瘤中产生了表型的多样性。特定癌症类型的特定基因改变与预后、对治疗(尤其是靶向治疗)的反应或抗性、以及肿瘤获得进一步突变的倾向以及其他表型有关。然而,在患者身上推断基因型与表型的联系是具有挑战性的,因为任何两个肿瘤在遗传上有太多的不同,无法分离出一个或几个突变的影响。将癌症相关的突变或其组合与它们的表型系统性地联系起来的能力将促进科学家们对癌症发病机制和遗传相关疾病特征的理解。
在一项新的研究中,来自布罗德研究所、丹娜法伯癌症研究院、布莱根妇女医院和哈佛医学院等研究机构的研究人员认为,可以利用基因组编辑和癌症相关突变的适应度优势来建立人类肿瘤发生的细胞模型。这样的基因组编辑模型将重现精确的遗传学特性、谱系关系和癌症的逐步发展,从而允许他们在受控的实验设计中建立基因型到表型的联系。相关研究结果发表在2022年4月29日的Science期刊上。
虽然对于来源于自我更新的干细胞的肿瘤已经有了类似的模型,特别是结直肠癌,但是对于来源于非干细胞分化细胞(nonstem differentiated cell)的肿瘤类型还没有类似的模型。这些作者提出了一种方法:从黑色素瘤的非干细胞起源---健康的人类黑色素细胞---开始,然后产生了一系列对关键癌基因突变进行精确基因组编辑的细胞,从而扩大了癌症产生的可能细胞模型。
这些作者产生了一系列渐进式基因组编辑的人类黑色素瘤模型。他们从健康的人类黑色素细胞开始,以循序渐进的方式引入了多达五个基因的突变,这些基因横跨在黑色素瘤中经常出现失调的六条通路:CDKN2A(RB通路的一部分)、BRAF(MAPK)、TERT(端粒酶)、PTEN(PI3K/AKT)、TP53(P53)和APC(Wnt),共建立了九种遗传上不同的细胞模型。
【4】Nat Commun:科学家开发出一种能预测胃癌患者对疗法产生反应的新型模型
doi:10.1038/s41467-022-28437-y
基因组分析或能提供预后和可预测的信息来帮助指导临床护理,目前研究人员仍然缺乏可靠地预测胃癌患者对化疗和免疫检查点抑制剂疗法产生反应的生物标志物;近日,一篇发表在国际杂志Nature Communications上题为“Development and validation of a prognostic and predictive 32-gene signature for gastric cancer”的研究报告中,来自延世大学医学院等机构的科学家们通过研究证实了利用基因组测序技术或能预测胃癌患者能从化疗或免疫疗法中获益的可能性。
包围在癌细胞周围的杀伤性T细胞。
图片来源:NIH
研究者Tae Hyun Hwang说道,胃癌是全球癌症相关死亡的主要原因,大部分的胃癌患者都会接受化疗进行治疗,有时候也会接受免疫疗法作为其疗法计划的一部分;然而并非所有患者都能从疗法中获益;于是研究人员试图利用基因组测序技术来构建一种模型,从而来预测患者能从化疗或免疫疗法中获益的可能性。
为了构建这种模型,研究者开发并实施了机器学习算法来整合5000多名患者的遗传学数据,随后他们开发了一种32个基因组成的分子特征,并用于指导患者的护理决策;Hwang说道,我们很高兴这32个基因标志不仅能提供预后信息,还能预测患者是否会从化疗或免疫疗法中获益,尤其研究人员对他们所识别出的能预测患者对免疫疗法反应的32个基因标志感到非常惊讶,因为是辈出胃癌患者机体中对免疫疗法产生反应的可靠生物标志物一直是该研究领域的一大挑战。
研究者表示,这32个基因分子标志仍然需要进行前瞻性研究进行证实,但他们相信最终或能识别出对免疫疗法和化疗产生反应的患者;同样地,研究人员也能识别出不太可能从这两种疗法中获益的患者,从而就会使其免受这些疗法所产生的潜在副作用及其影响。
【5】eLife:科学家开发出新型模型来预测患者对癌症免疫疗法的早期反应
doi:10.7554/eLife.70130
癌症的检查点抑制剂疗法能显著改善多种实体恶性肿瘤患者中一部分患者的生存率,然而驱动这种临床反映或缺乏反应的因素,目前研究人员并不清楚。近日,一篇发表在国际杂志eLife上题为“Early prediction of clinical response to checkpoint inhibitor therapy in human solid tumors through mathematical modeling”的研究报告中,来自休斯顿卫理公会研究所等机构的科学家们通过研究开发了一种新型模型,其或能在患者疗法早期预测是否癌症患者会对免疫疗法产生反应。
这种模型或能为临床医生提供一种方法,利用医院扫描和实验室检测的数据信息来识别出哪些患者在癌症疗法早期能因免疫疗法而获益,这或许就会促进癌症患者接受个体化的疗法并避免一些患者经历无法在其机体中发挥作用的疗法所产生的副作用影响。研究者Zhihui Wang说道,尽管免疫疗法能改善一部分癌症患者的生存,但持久的治疗效应仍然仅能在一小部分患者机体中观察到。数学模型能够定性或定量分辨出癌症中存在的潜在复杂生物学和物理学过程,并能帮助优化疗法决策;为此研究人员就想通过研究来阐明诸如扫描图像和对组织进行活组织检查分析等标准的临床手段如何能被用来构建模型,进而预测哪些患者能因免疫疗法而获益。
文章中,研究人员重点分析了患者如何对免疫检查点抑制剂疗法产生反应,他们设计了一种模型,分析在患者开始该疗法后随着时间相对肿瘤质量的变化情况,肿瘤质量的变化会受到免疫系统和癌细胞之间复杂生物学串扰的影响,研究者通过重点分析三个能够组合成为方程的测量来简化这种串扰,即恶性肿瘤细胞生长的能力、肿瘤环境中免疫细胞杀灭癌细胞的能力以及基于检查点抑制剂的免疫疗法的治疗效力。
【6】Nat Ecol & Evol:科学家开发出一种新型计算机模型 或能帮助理解肿瘤的生长影响其遗传特性的机理
doi:10.1038/s41559-021-01586-x
肿瘤内的遗传异质性会促进克隆进化,然而目前研究人员对临床相关的克隆动态变化的理解仍然非常有限,近日,一篇发表在国际杂志Nature Ecology & Evolution上题为“Spatial patterns of tumour growth impact clonal diversification in a computational model and the TRACERx Renal study”的研究报告中,来自Francis Crick研究所等机构的科学家们通过研究开发了一种新型的计算机模型,其或有望帮助分析肿瘤的生长方式如何影响其遗传组成。利用这种新型模型,研究人员识别出了肿瘤生长和性状之间的关联,以及患者机体的癌症可能进展的速度到底有多快。

体积生长模型(上)和表面生长模型(下)中硅片肿瘤的代表。
图片来源:The Francis Crick Institute
随着癌细胞的突变,一些癌细胞就会通过突变获得优势从而使其更有可能生存、分裂并产生一群更为适合的细胞,比如,如果其已经进化到能在营养物质或氧气供应不足的条件下生存,这组细胞就可能会超越其它细胞而占据主导地位。肿瘤进化的过程具有高度复杂性,其受到了多种因素的影响,包括肿瘤的生长方式,但科学家们对其并不是非常理解。
这篇研究报告中,研究人员利用其所开发的新型计算机模型研究了肾脏癌症中两类肿瘤的生长,其中一种是整个肿瘤的生长是一致的,即“体积生长模型”,另外一种则仅限于细胞表面,即“表面生长模型”。在体积生长模型中会出现两种情况,在某些情况下,在肿瘤的早期阶段会出现一种单一适合的遗传相关的癌细胞群,而在其它情况下,肿瘤则不会产生适合的细胞群,而是原来的亲代癌细胞群仍然占据着主导地位。
在表面生长模型中存在着广泛的遗传多样性,不同的适合细胞群会在表面形成,这或许就创造出了一种竞争性的环境,不同的细胞群会被推动着进化地更快。研究者Xiao Fu说道,我们已经采取了两种不同的生长模型,并识别出了肿瘤随着时间和空间上演变的明显差异,而这是在真实的组织中很难做大的,因为其需要从肿瘤的不同部位反复进行多次活检,这些发现仅仅是研究人员希望通过这一模型发现的一个开始。
【7】Nat Commun:科学家开发出一种在凝胶中生长的迷你乳腺癌模型 或有望帮助开发更高效的抗癌疗法
doi:10.1038/s41467-021-27220-9
目前,乳腺癌是芬兰工作年龄段中最常见的癌症形式,大多数乳腺癌属于一种所谓的激素受体阳性亚型,这意味着癌细胞上存在一些激素受体,其会接受来自机体的激素并诱发连锁反应,从而增加癌症的生长。利用激素疗法就能有效治疗这些乳腺癌。然而,在大约40%的病例中,疗法的治疗效果会随着时间的推移而下降,直到用药物治疗难以控制癌症。此外,由于激素受体在实验室细胞培养条件下会从乳腺癌细胞中完全消失,研究激素疗法的效果、缺乏治疗反应以及可能对无反应性的癌症有效的新疗法就会出现相应的问题。
近日,一篇发表在国际杂志Nature Communications上题为“Compressive stress-mediated p38 activation required for ERα+ phenotype in breast cancer”的研究报告中,来自赫尔辛基大学等机构的科学家们通过研究发现了一种新方法,其或能在实验室条件下将激素受体保留在凝胶中培养生长的迷你乳腺癌中,这一发现为后期科学家们开发新型激素疗法,并研究个体药物反应和阐明药物耐受性的分子机制提供了新的线索。
长期以来,科学家们一直在研究为何当乳腺癌细胞或癌症组织碎片从乳腺癌手术转移到细胞培养过程时,其激素受体就会消失。研究者Pauliina Munne指出,尽管我们找遍了几乎所有可能的生长因子和培养基,但研究并没有真正产生结果,最后的结果都是激素受体都会消失。随后研究人员清楚地认识到,回答这个复杂生物学问题的答案需要将癌症生物学与材料化学和软物质物理学这些不同学科结合起来。
只有当我们模仿乳腺组织所经历的自然机械特性,比如高硬度时,我们才能够保持癌细胞中存在的激素受体;让研究人员非常高兴的时,它们也扮演了激素受体的角色,最重要的是,根据本文研究结果,研究人员就能利用新一代的激素药物来阻断其行为。研究者控制基于水凝胶的纳米支架的机械、生化学和化学功能的能力或许就能提供对病人机体衍生组织的长期研究,也能为一种新型和可预测的临床前模型铺平一定的道路。
【8】Sci Adv:新型小鼠模型或能帮助揭开人类乳腺癌的弱点及对疗法的耐受性机制!
doi:10.1126/sciadv.abc8145
大多数乳腺癌患者的死亡都是由雌激素受体α阳性(ER+)疾病所引起的,临床前的研究进展因缺乏能再现疾病转移进展和临床相关疗法耐受性的疗法原始性ER+肿瘤模型而受到了一定的阻碍;人类催乳素(hPRL)或许就是原发性和转移性ER+乳腺癌发生的一个风险因素;近日,一篇发表在国际杂志Science Advances上题为“NSG-Pro mouse model for uncovering resistance mechanisms and unique vulnerabilities in human luminal breast cancers”的研究报告中,来自威斯康星医学院等机构的科学家们通过研究开发出了一种激素特性谱改进型的小鼠模型,这种激素谱或能支持所植入的人类乳腺肿瘤的生长和转移扩散。
长期以来,在小鼠机体中培育出来自患者机体的未经治疗的ER+乳腺肿瘤,对于科学家们而言一直是一大挑战;诸如这种人类乳腺肿瘤模型的缺乏往往会阻碍科学家们识别更好的药物或药物组合的努力,因此科学家们就需要开发出更有效的疗法来预防机体对治疗方法频繁产生耐受性,从而就会降低乳腺癌患者的死亡率。
ER+乳腺肿瘤对激素催乳素敏感,催乳素因其能促进母亲的乳汁分泌而为人所熟知,此前研究人员发现,小鼠机体的催乳素并不能激活人类的催乳素受体,于是他们就推测,这种激素缺陷是小鼠机体中的人类ER+乳腺肿瘤生长不良的关键。研究者指出,通过修饰小鼠机体的催乳素基因,他们就能开发出一种特殊的小鼠模型,在这种小鼠模型机体中,其产生人类催乳素的水平类似于在患者机体中所检测到的水平;这种名为NSG-Pro的新型小鼠模型或能支持所植入的ER+人类乳腺肿瘤快速生长;对肿瘤组织进行分子通路分析结果表明,催乳素能与雌激素和HER2互相协作发挥作用,后两者是已经公认的乳腺癌的生长因子。
如今研究人员在NSG-Pro小鼠中就能生成一组可移植的雌激素依赖性的患者衍生的乳腺肿瘤模型,当植入到NSG-Pro小鼠的乳腺中后,多个新型的肿瘤品系就会通过扩散到远端器官来重现患者机体中的疾病进展状况。研究者Hallgeir Rui博士说道,我们非常感兴趣研究癌症的远端转移以及药物对晚期ER+乳腺癌的治疗效应,因为截止到目前为止并没有此类实验性模型能被使用;这一点特别重要,因为乳腺癌患者往往会因疾病的远端转移而死亡。
【9】Nat Commun:实验室培养的肿瘤模型或有望帮助改善胰腺癌患者的治疗和疾病预后
doi:10.1038/s41467-021-25921-9
如今,人类癌症的患者衍生体内模型已经成为现实,但其周转时间不足以满足当前的临床应用,因此研究者就迫切需要开发出能再现体内肿瘤生物学特性的定制化体外模型,这些模型尤其有利于胰腺导管腺癌的研究,对于这类癌症而言,当前疗法的失败归因于较高的癌症干细胞含量以及高密度的基质细胞和细胞外基质。近日,一篇发表在国际杂志Nature Communications上题为“Bioengineered 3D models of human pancreatic cancer recapitulate in vivo tumour biology”的研究报告中,来自英国伦敦大学学院等机构的科学家们通过研究在实验室中创建了一种3-D胰腺癌肿瘤模型,其结合了生物工程基质和患者衍生的细胞,从而有望用于开发并检测靶向性疗法的治疗效率。
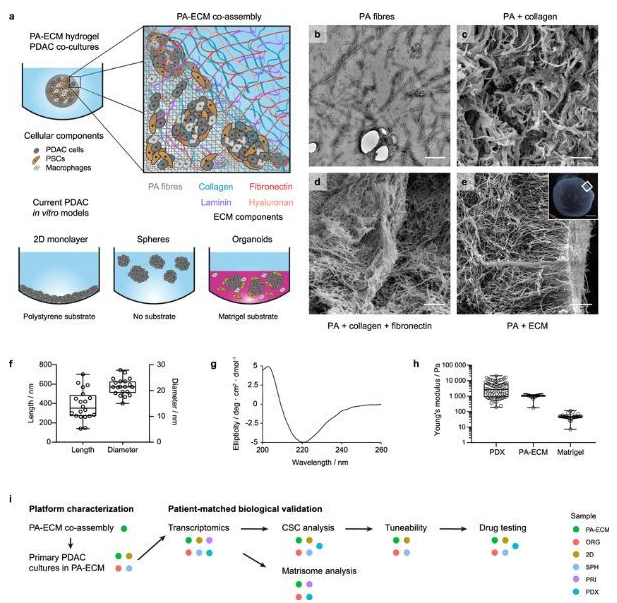
PA-ECM共组装矩阵的设计与表征。
图片来源:Osuna de la Peña, D., et al. Nat Commun 12, 5623 (2021). doi:10.1038/s41467-021-25921-9
研究者表示,他们所开发的多细胞3-D微环境能利用患者机体衍生的细胞来重现肿瘤细胞在胰腺癌中的生长方式以及如何对化疗药物产生反应。胰腺癌是一种难以治疗的爱着那个,特别是在患者机体癌症扩散前其都不会有任何疾病迹象或症状,这类癌症通常对疗法耐受且患者的生存率低于其它癌症类型,胰腺癌患者诊断后5年的存活率仅为5%-10%。
研究者David Osuna de la Pena表示,如今在治疗胰腺癌上我们面临着量大障碍,即非常密集的蛋白质基质和主要参与疾病复发和转移的高度耐受性癌症干细胞(CSCs)的存在;文章中,研究人员设计了一种基质,在其中癌症干细胞能与其它细胞类型相互作用,并共同表现地像在体内一样,从而就为以更现实的方式来检测不同疗法的效率提供了一定的可能性。研究人员非常有必要改进3-D模型来研究患者机体中肿瘤的生长和进展,并检测其对新型疗法的反应;目前,90%的临床前测试成功的癌症疗法在临床试验的早期阶段都失败了,仅有不到5%的肿瘤药物在临床试验中取得了一定的成功。
【10】Hepatology:科学家建立新的肝内胆管癌小鼠模型,并鉴定到重要癌症发生相关基因
doi:10.1002/hep.31834
肝内胆管癌(intrahepatic cholangiocarcinoma, iCCA)的预后不佳,很大原因是由于诊断不够及时造成的,因此iCCA的早期诊断和及早治疗是提高疾病治愈效果的必要条件,但有关肝内胆管癌前体病变的起始和发展的信息有限。近日,来自比利时鲁汶大学的科学家们在Hepatology杂志上发表题为“A novel mouse model of cholangiocarcinoma uncovers a role for Tensin-4 in tumor progression”的文章,称开发了一种新的小鼠模型,很好地再现了人类iCCA肿瘤发生,并发现了TNS4在肿瘤进展过程中的重要作用。
使用真实再现人类肿瘤发生过程的实验模型来识别驱动癌前病变形成及其向侵袭性肿瘤发展的机制是非常有必要的。为此,作者建立了一种新的小鼠模型,该模型结合了胆管细胞特异性表达的KrasG12D和DDC (3,5-diethoxycarbonyl-1,4-dihydrocollidine)饮食诱导的炎症反应。结果显示,在胆管细胞中表达KrasG12D并饲喂DDC饮食的小鼠发生了胆管炎、导管增生、导管内乳头状肿瘤(intraductal papillary neoplasms of bile ducts, IPNBs)和最终的iCCA。与人类iCCA一致,MAPK, AKT, Notch, TGF?和ERBB信号通路在该小鼠模型肿瘤发生过程中同样均被激活。上述结果表明该模型可以成功模拟胆管炎患者中iCCA的发展。
为了深入了解肿瘤进展的机制,我们研究了该小鼠肿瘤模型中的导管增生、IPNBs和iCCAs的转录组学。发现IPNB和iCCAs的表达谱非常相似,支持iCCA来源于IPNBs。作者进一步对两者的差异基因进行了研究,发现粘着斑蛋白(focal adhesion protein) TNS4在小鼠模型和人类iCCAs中均明显高表达,表明Tensin-4可能在iCCAs进展过程中发挥重要作用。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


