《细胞》子刊:华人科学家首次揭示间皮细胞在肿瘤里的重要功能,为免疫治疗打开了新方向
来源:奇点糕 2022-05-24 10:25
据相关研究报道,预计到2030年,胰腺导管腺癌(PDA)将会成为美国癌症相关死亡的第二大主要致死原因[1]。但是截止到目前为止,PDA尚无有效的治疗方法
据相关研究报道,预计到2030年,胰腺导管腺癌(PDA)将会成为美国癌症相关死亡的第二大主要致死原因[1]。但是截止到目前为止,PDA尚无有效的治疗方法,其中一部分原因是肿瘤进展过程中会发生促纤维增生反应[2]。
在肿瘤微环境(TME)中,除了肿瘤细胞外基质,还存在大量各种类型的基质细胞,例如癌症相关的成纤维细胞(CAFs)、髓样细胞、淋巴细胞和血管内皮细胞,这些基质细胞在肿瘤发展中的作用逐渐引起人们的关注。其中,CAFs正是促纤维化反应发生的主要驱动因素,但是现有研究对其表征很少,要想以CAFs为突破口来治疗肿瘤,仍需深入探索。
近日,来自美国德克萨斯大学西南医学中心的黄活聪和Rolf A.Brekken带领的研究团队发现,抗原递呈癌症相关成纤维细胞(apCAF)起源于间皮细胞,且能够通过激活CD4+ T细胞分化为调节性T细胞(Tregs),导致肿瘤免疫逃逸,从而促进胰腺导管腺癌进展。相关研究成果已发表在Cancer Cell期刊上[3]。
这项研究成果为间皮细胞如何有助于PDA的免疫逃逸提供了依据,同时也为增强癌症免疫治疗的策略提供了参考。

论文首页截图
一直以来,人们认为CAFs是一种能够在TME中支持肿瘤进展的间质细胞,且成分和来源较为统一,可以通过分泌细胞因子、生长因子等手段产生和重构细胞外基质,促进PDA进展[4]。
实际上,CAFs也有着“多副面孔”,呈现出异质性。比如具有肌纤维母细胞特征的CAF(myCAF)、具有炎症特征的CAF(iCAF),以及这次的“主角”——具有抗原提呈能力的CAF(apCAF)。
在这项研究中,针对apCAF在PDA进展中的作用,黄活聪、Rolf A.Brekken及其同事们进行了探索。
首先,他们整合多个来源的单细胞测序数据,通过细胞亚群特征聚类分析成纤维细胞簇,结果发现apCAF来源于间皮细胞。
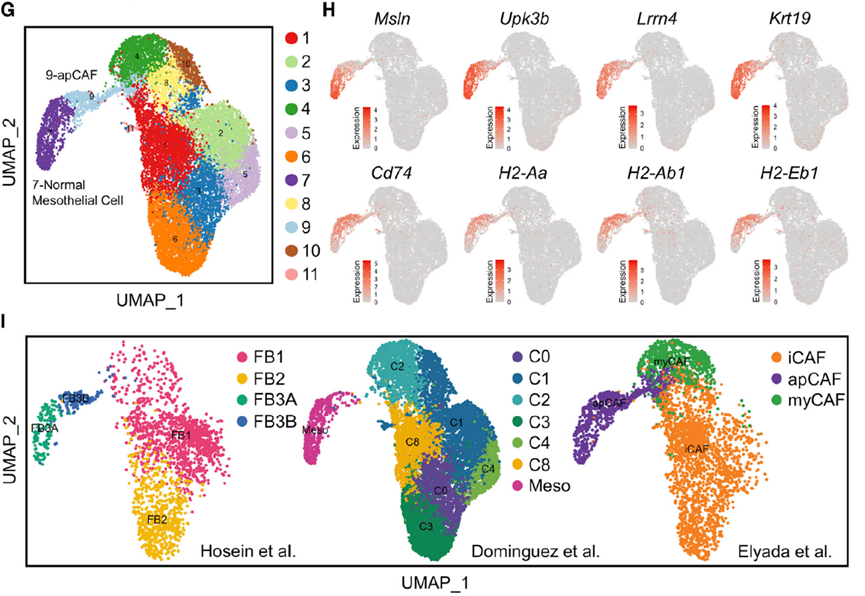
scRNA-seq整合多个数据集分析正常间皮细胞apCAF之间的关系
根据结果显示,apCAF不仅表达主要组织相容性复合物II类(MHC II)特征基因(Cd74, H2-Ab1等),还同时表达间皮细胞特征基因(Upk3b, Krt19等)。
为了验证间皮细到apCAF的转化、并确定间皮细胞在PDA进展过程中的动态,研究者基于间皮细胞特异性基因Wt1,构建了基因编辑的小鼠模型(Wt1CreERT2;R26LSL-tdTomato),并对间皮细胞进行谱系追踪。
结果显示,在正常胰腺中,间皮细胞不表达纤维母细胞标志物,如平滑肌肌动蛋白(aSMA)和白介素-6(IL-6);而在PDA基质中,可观察到间皮细胞大量表达aSMA、IL-6。这提供了强有力的证据,表明间皮细胞在PDA中具有成纤维细胞的特征,并有助于基质的形成。
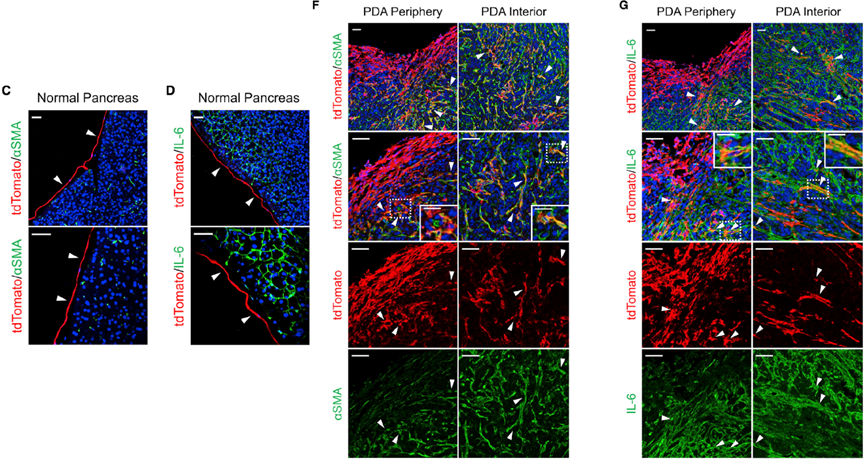
相比较正常胰腺组织,间皮细胞在PDA组织中大量表达成纤维特征蛋白(aSMA和IL-6)
也就是说,几乎覆盖在体内每个器官上的间皮细胞,竟是apCAF的“前世”。在PDA肿瘤微环境中,间皮细胞可以转化为apCAF。
值得注意的是,apCAF虽然可以通过MHC II分子将抗原提呈给CD4+ T细胞,但是缺乏诱导CD4+ T细胞完全活化及克隆扩增所必须的共刺激分子(如CD40,CD80,CD86)。而有研究表明,一旦抗原提呈细胞(APC)缺乏共刺激分子,则会导致T细胞无反应或者诱导产生Tregs[5]。
要知道,Tregs是一种特殊的T细胞亚群,其作用是抑制免疫反应,在自身免疫性疾病或是癌症的免疫逃逸中都发挥重要功能[6]。
所以,apCAF和T细胞之间到底发生了什么?又与Tregs有什么关系呢?
研究者将来自正常胰腺的APC(树突细胞、巨噬细胞等)、iCAF、myCAF、正常间皮细胞,以及来自PDA小鼠模型(KPfC,KrasLSL-G12D/+;Trp53fl/fl;Pdx1Cre/+)的apCAF,进行体外共培养实验,以对比这几种细胞的抗原递呈能力以及诱导CD4+ T细胞的活化能力。
他们将上述细胞进行分选并与卵清蛋白(OVA)共培养之后,与小鼠(OT-II)中分离的CD4+ T细胞再培养。结果发现,APC、正常间皮细胞、apCAF都能以OVA特异性方式诱导T细胞表达早期激活标志物CD25和CD69,而iCAF、myCAF则不能。
进一步研究表明,apCAF确实可以促进CD4+T细胞分化为具有免疫抑制功能的Tregs细胞。
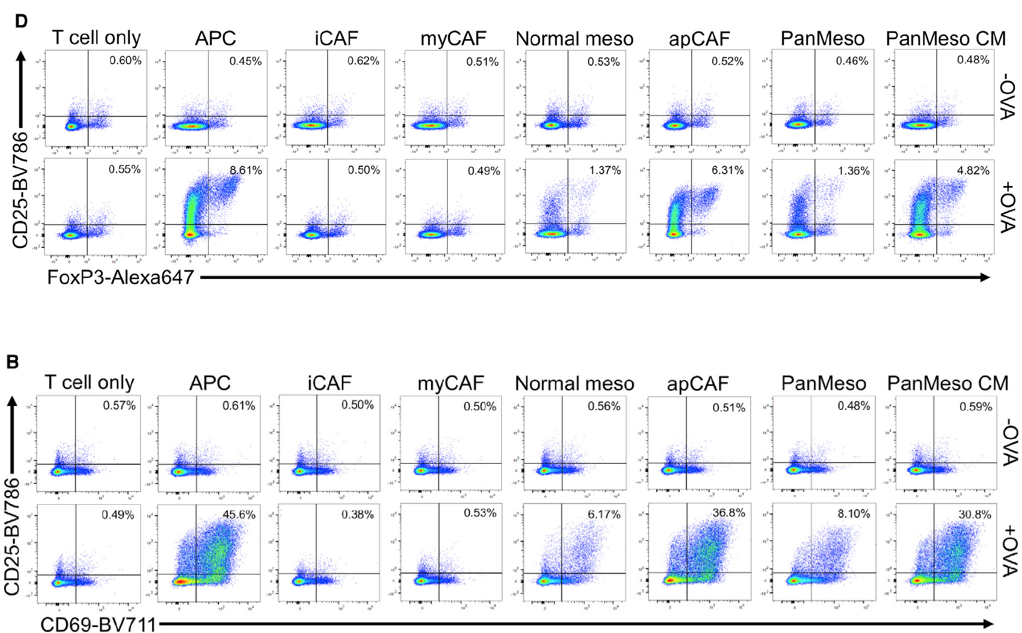
apCAF可以通过抗原依赖性TCR连接诱导Tregs的形成和增殖
接下来,研究者对驱动间皮细胞转换为apCAF的信号通路进行探索。
通过分析上调表达的差异基因,他们发现,与间皮细胞相比,apCAFs中的TGFβ信号通路以及由IL-1介导的NF-Kb信号通路显著富集。而在之前有研究证实,这两种信号通路还是造成PDA中CAFs异质性的主要原因[7]。
如果使用IL-1或TGFβ刺激处理胰腺来源的间皮细胞,再与CD4+ T细胞在体外共培养,即可增强T细胞受体(TCR)的活化。
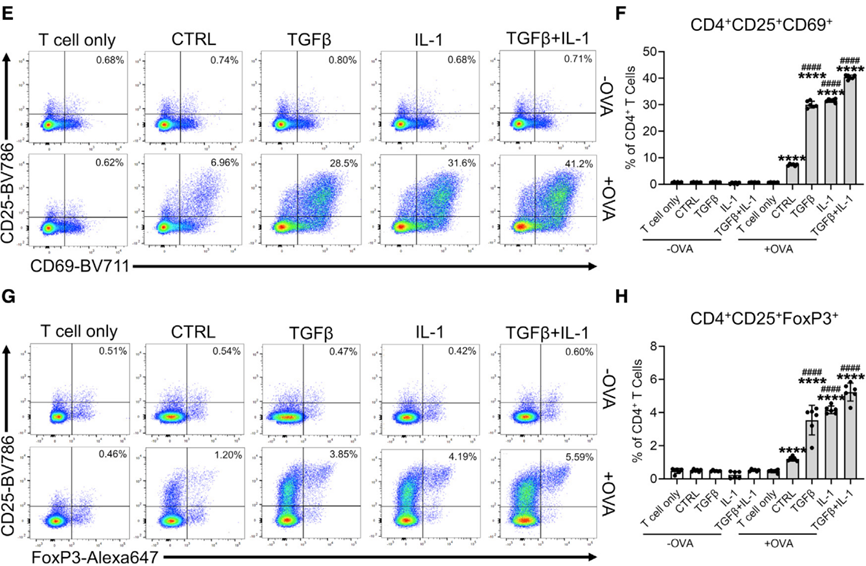
IL-1和TGFβ信号参与间皮细胞向apCAFs的诱导
美中不足的是,IL-1、TGFβ并不适合在临床中作为一个特异性药物靶点。这两个信号虽然介导间皮细胞→apCAF的转化,但是它俩“身兼数职”,参与很多生物学过程,包括其他CAFs(iCAF、myCAF)的形成。
不过,间皮细胞的标记物——间皮素(MSLN)是个不错的治疗靶点。
研究者发现,当使用靶向MSLN的单克隆抗体(mAb)来治疗PDA小鼠时,可以有效抑制间皮细胞向成纤维细胞转化,并显著降低肿瘤重量以及Tregs/CD8+ T细胞比例,达到缓解PDA进展的作用。
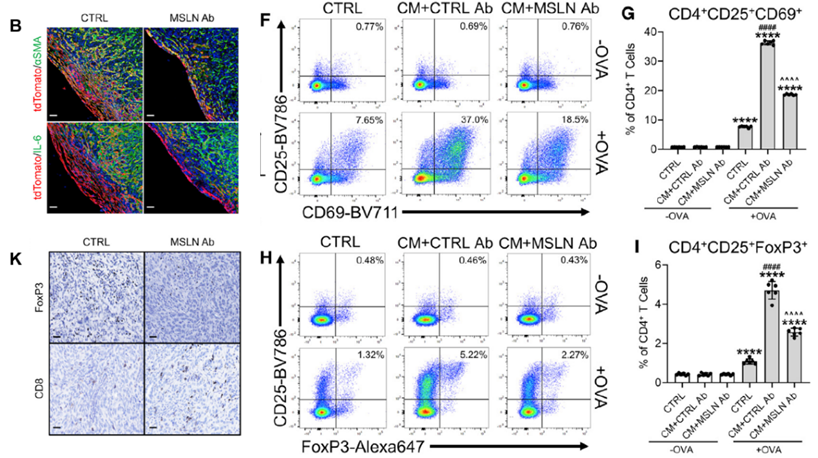
MSLN阻断可以抑制间皮细胞向apCAF的转换,抑制Tregs生成从而缓解PDA进展
总而言之,在本项研究中研究者首次确定间皮细胞是apCAF的来源,并揭示apCAF在胰腺导管腺癌进展中的作用。通过成纤维细胞的特征转化,间皮细胞将会形成apCAF。而apCAF能够诱导Treg细胞的形成,从而直接作用于肿瘤免疫调节,促进胰腺导管腺癌进展。
由于大多数动物器官表面都覆盖有一层间皮细胞,了解间皮细胞向apCAF转化的过程以及apCAF的功能,可能不仅限于PDA,同样对其他肿瘤的免疫治疗具有参考价值。
另外,研究者在这里发现,靶向MSLN的单抗能够有效抑制apCAF的形成,并降低Tregs/CD8+ T细胞比例,有助于抗肿瘤免疫反应发挥作用。
而这个MSLN,由于在多种实体瘤中的高表达以及在其他关键组织中的低表达,已成为癌症治疗的一个有吸引力的靶点。MSLN不仅表达于正常胸膜、心包和腹膜的间皮细胞,在许多类型的癌细胞上也有表达,包括PDA、卵巢癌、子宫内膜癌、肺癌、胆管癌、胃癌和乳腺癌等[8] 。这意味着,靶向MSLN的免疫治疗,可能是通过同时作用于癌细胞和apCAF,而产生了协同作用。
参考文献:
[1]RAHIB L, SMITH B D, AIZENBERG R, et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States [J]. Cancer Res, 2014, 74(11): 2913-21.
[2]HOSEIN A N, BREKKEN R A, MAITRA A. Pancreatic cancer stroma: an update on therapeutic targeting strategies [J]. Nat Rev Gastroenterol Hepatol, 2020, 17(8): 487-505.
[3]HUANG H, WANG Z, ZHANG Y, et al. Mesothelial cell-derived antigen-presenting cancer-associated fibroblasts induce expansion of regulatory T cells in pancreatic cancer [J]. Cancer Cell, 2022.
[4]LEBLEU V S, KALLURI R. A peek into cancer-associated fibroblasts: origins, functions and translational impact [J]. Dis Model Mech, 2018, 11(4).
[5]SEMPLE K, NGUYEN A, YU Y, et al. Strong CD28 costimulation suppresses induction of regulatory T cells from naive precursors through Lck signaling [J]. Blood, 2011, 117(11): 3096-103.
[6]WING J B, TANAKA A, SAKAGUCHI S. Human FOXP3(+) Regulatory T Cell Heterogeneity and Function in Autoimmunity and Cancer [J]. Immunity, 2019, 50(2): 302-16.
[7]BIFFI G, ONI T E, SPIELMAN B, et al. IL1-Induced JAK/STAT Signaling Is Antagonized by TGFbeta to Shape CAF Heterogeneity in Pancreatic Ductal Adenocarcinoma [J]. Cancer Discov, 2019, 9(2): 282-301.
[8]DEL BANO J, FLORES-FLORES R, JOSSELIN E, et al. A Bispecific Antibody-Based Approach for Targeting Mesothelin in Triple Negative Breast Cancer [J]. Front Immunol, 2019, 10: 1593.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


