Nature 子刊:单细胞测序揭秘治疗白血病的新方法
来源:生物谷 2021-03-27 17:29
急性髓细胞性白血病(AML)是一类起源于白血病干细胞(LSC)的恶性克隆性疾病,但由于癌症干细胞的丰度低且与健康的造血干细胞(HSC)具有高度相似性而难以分离,因此阻碍了国际上针对靶向人体恶性细胞同时保留正常细胞的精密治疗方法的研究。
单细胞转录组克隆追踪鉴定白血病及白血病前期干细胞
具有高细胞更新率的组织(例如造血系统或肠道)依赖于“专业”成年干细胞来进行持续再生。这些细胞中的致癌突变可导致癌症,使癌症保持原始组织的层次结构。只有位于顶层的癌症干细胞(CSC)才能促进长期的癌症生长并推动复发,而大部分癌症由迅速分裂的细胞组成,这些细胞具有自我更新的能力,即在有限的2至4次分裂后耗尽其复制潜能的细胞。由于具有干细胞样特性,CSC构成了复发的重要驱动力,但其低分裂率使它们难以靶向治疗。因此,迫切需要能够可靠地识别和表征CSC的工具。
基于此,来自美国加利福尼亚州帕洛阿尔托市斯坦福基因组技术中心Lars M Steinmetz教授,带领团队证明了通过结合单细胞转录组学和沿袭追踪使用核和线粒体体细胞变异体,可以鉴定出LSCs,HSCs和白血病前干细胞并对其进行分子谱分析。虽然突变状态可以区分健康细胞和癌细胞,但基因表达可以区分干细胞和祖细胞群。相关研究成果以“Identification of leukemic and pre-leukemic stem cells by clonal tracking from single-cell transcriptomics”为题,在线发表在《Nature Communication》杂志上。
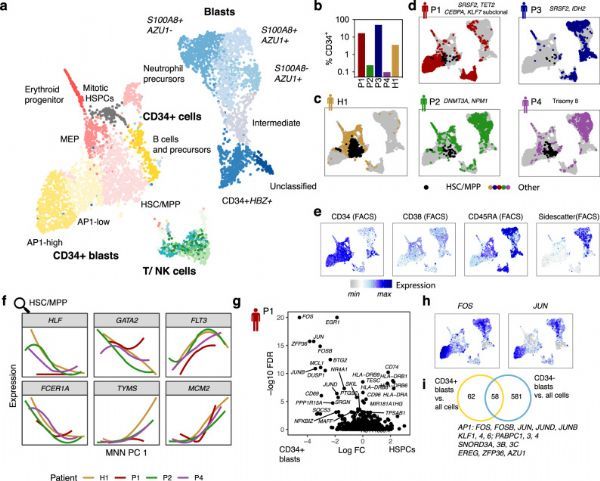
为了建立用于单细胞转录组数据中人类细胞的克隆追踪的鲁棒实验装置,研究人员评估了Smart-seq2协议的各种修改,旨在增加目标多态性基因组位点的覆盖率。其中发现在逆转录过程中包含靶向引物经常会导致形成不希望的副产物,特别是在靶向更多位点时。相比之下,当在cDNA扩增过程中将目标位点作为目标时,该研究团队获得了高质量的转录组数据,同时与非目标方法相比,每个细胞捕获的目标位点的平均数目增加了2-4倍。MutaSeq可以稳定地与多达30–40个引物对(靶标)结合使用,当包含更多引物时,文库质量逐渐降低。在仅使用高度表达的靶基因的测试中,实际上是在所有单个细胞中从所有引物对创建了靶扩增子。
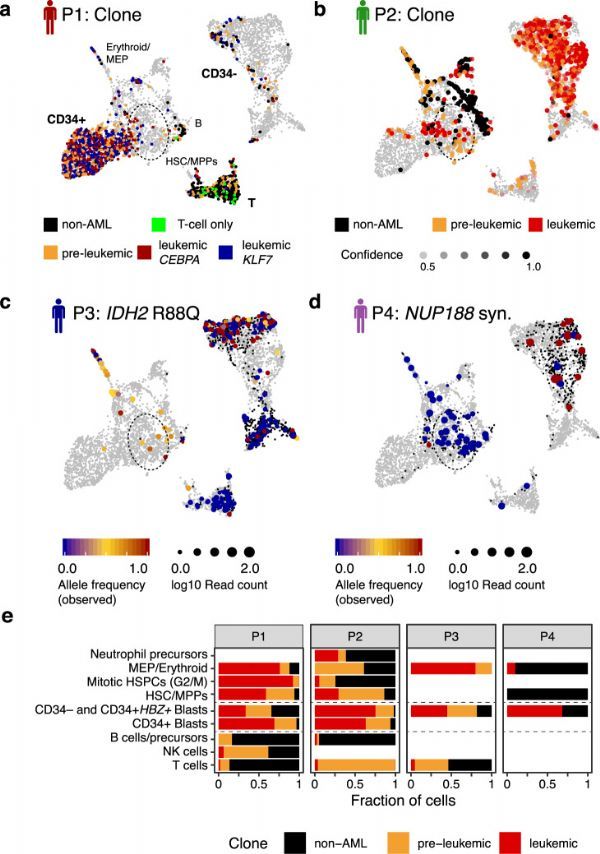
然后,研究人员将单细胞水平的核基因组突变以及线粒体突变称为单细胞水平,以将细胞聚类为克隆层次。患者的大量外显子组测序已鉴定出以高等位基因频率出现的已知白血病前突变和以稍低等位基因频率出现的已知白血病突变(患者1:突变SRSF2,TET2 / CEBPA和SRSF2,TET2 / KLF7 ; 患者2:DNMT3A / NPM1中的突变;患者3:SRSF2 / IDH2突变;患者4:白血病三体性8和BRAF突变)。尽管可以仅根据这些核体细胞突变的调用来得出关于克隆层次的某些陈述,但是这些位点的相对较高的缺失 阻碍了细胞对克隆的稳健分配。此外,结果受到感兴趣的突变基因的表达水平的影响:在低表达的细胞中,失靶率更高,导致假阴性检出率更高,即以突变细胞的错误分类作为参考。
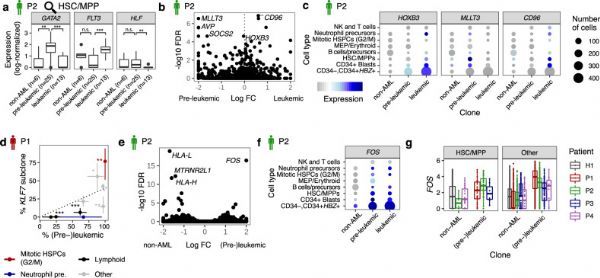
为了进一步证明该研究团队鉴定从头克隆的能力,研究人员着重介绍了P2中非白血病细胞的克隆扩增。这个克隆将已经通过的办法单独依靠基因突变错过了。有趣的是,这些细胞与白血病前的DNMT3A突变无关。通过再次使用β-二项式模型查询来自COSMIC数据库的位点,确定了它们在RPL3基因中具有独特的突变。这些结果表明,该克隆扩增事件与白血病无关,并且与无关核突变的获得有关。研究人员还注意到一个单个线粒体变体(5492T> C)标记的P1中假定的非白血病克隆。除了一个例外,所有携带这种变异的细胞都对T细胞标记CD3呈阳性反应。因此,尽管不能正式排除它对应于T细胞特异性RNA编辑事件,但该变异可能是在T细胞前体或T细胞克隆中获得的。
综上所述,该研究描述了一种联合单细胞转录组学和克隆跟踪方法(MutaSeq和mitoClone),用于表征LSC,绘制其分化能力并绘制致癌突变的分子结果。虽然单细胞基因表达谱分析可以鉴定具有干细胞特征的细胞,但是使用基因组和线粒体突变进行克隆追踪可以在健康克隆和癌性克隆之间进行清晰的分离。因此,本研究区分了LSC、HSC、LSC前、健康祖细胞和胚细胞,且已经在急性髓细胞性白血病的背景下证明了这种方法,进一步表明类似的方法可以应用于其他类型的癌症。
参考文献
Velten L, Story BA, Hernández-Malmierca P, et al. Identification of leukemic and pre-leukemic stem cells by clonal tracking from single-cell transcriptomics. Nat Commun. 2021 Mar 1;12(1):1366. doi: 10.1038/s41467-021-21650-1. PMID: 33649320; PMCID: PMC7921413.
Sachs K, Sarver AL, Noble-Orcutt KE, et al. Single-Cell Gene Expression Analyses Reveal Distinct Self-Renewing and Proliferating Subsets in the Leukemia Stem Cell Compartment in Acute Myeloid Leukemia. Cancer Res. 2020 Feb 1;80(3):458-470. doi: 10.1158/0008-5472.CAN-18-2932. Epub 2019 Nov 29. PMID: 31784425; PMCID: PMC7002190.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->