PNAS: 在胶质母细胞瘤模型中,STING激活促进强大的免疫反应和NK细胞介导的肿瘤消退
来源:生物谷原创 2022-07-25 16:24
该研究揭示了通过激活GBM中的STING激活TME的治疗潜力和深刻的重塑,并值得进一步研究STING激动剂或与其他免疫疗法联合使用。
免疫疗法已经深刻地改变了癌症的治疗。特别是,在某些癌症类型中,对免疫检查点阻断(ICB)的前所未有的反应清楚地表明,宿主免疫系统可以被重新训练以消除肿瘤。然而,许多肿瘤仍然对icb耐药,许多研究表明,这些肿瘤可能受益于创造更有利于免疫激活的肿瘤微环境的额外治疗。
因此,了解有效调节肿瘤内微环境所需的关键机制是一个非常重要的领域,而打破局部免疫抑制机制的治疗方法可能有助于开发有效的抗肿瘤免疫。在过去的十年里,免疫疗法对癌症的治疗产生了巨大的影响,在疾病的晚期和转移阶段出现了迄今为止未曾见过的反应。
然而,侵袭性脑肿瘤胶质母细胞瘤(GBM)具有高度的免疫抑制作用,对目前的免疫治疗方法仍然很难治疗。干扰素基因刺激物(STIN) DNA传感通路是新一代免疫治疗靶点,具有很强的局部免疫刺激作用。

图片来源: https://doi.org/10.1073/pnas.2111003119
近日,来自德克萨斯大学西南医学中心的研究者们在PNAS杂志上发表了题为“STING activation promotes robust immune response and NK cell–mediated tumor regression in glioblastoma models”的文章,该研究揭示了通过激活GBM中的STING激活TME的治疗潜力和深刻的重塑,并值得进一步研究STING激动剂或与其他免疫疗法联合使用,如癌症疫苗、嵌合抗原受体T细胞、NK疗法和免疫检查点阻断。
在本研究中,研究者研究了STING通路在基底膜中的地位以及STING激动剂Adu-S100对脑肿瘤微环境(TME)的调节。该数据显示,在人的基底膜标本中存在刺痛,它在肿瘤血管中强烈染色。
研究者发现人的GBM外植体可以通过分泌炎性细胞因子对刺痛激动剂的治疗产生反应。在小鼠GBM模型中,结果显示在STING激动剂治疗后,肿瘤免疫格局发生了深刻的变化,携带肿瘤的大脑半球大量渗透天然免疫细胞,包括炎性巨噬细胞、中性粒细胞和自然杀伤(NK)群体。
用可生物降解的Adu-S100负载的颅内植入物治疗已建立的小鼠颅内GL261和CT-2A肿瘤表明,这两种模型的存活率和GL261免疫记忆的长期存活率都有显著提高。由于NK细胞耗尽,对治疗的反应消失。
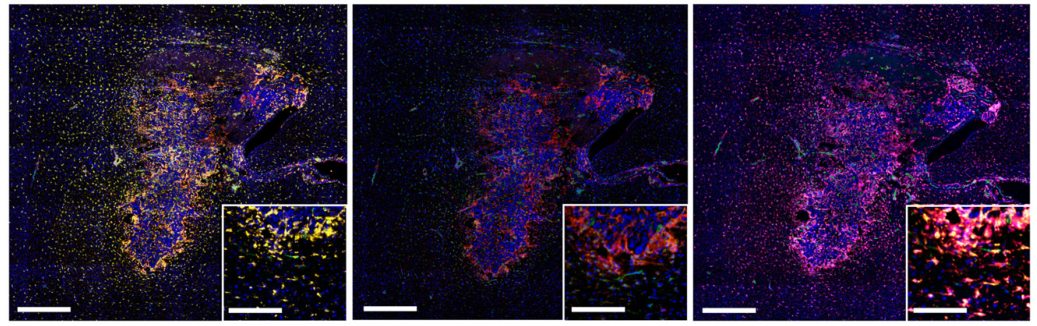
胶质母细胞瘤中STING通路表达的评估
图片来源: https://doi.org/10.1073/pnas.2111003119
综上所述,研究者有希望的数据证实了NK细胞在刺痛疗法的抗肿瘤作用中的重要性,并为在不久的将来使用刺痛负载的脑植入物重塑TME、触发免疫渗透以及支持联合疗法(ICB、细胞毒化疗)奠定了基础。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


